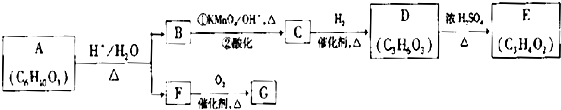
题目内容
【化学--选修2:化学与技术】
普通纸张的主要成分是纤维素,在早期的纸张生产中,常采用纸张表面涂敷明矾的工艺,以填补其表面的微孔,防止墨迹扩散.请回答下列问题:
(1)人们发现纸张会发生酸性腐蚀而变脆、破损,严重威胁纸质文物的保存.经分析检验,发现酸性腐蚀主要与造纸中涂敷明矾的工艺有关,其中的化学原理是______;为了防止纸张的酸性腐蚀,可在纸浆中加入碳酸钙等添加剂,该工艺原理的化学(离子)方程式为______.
(2)为了保护这些纸质文物,有人建议采取下列措施:
①喷洒碱性溶液,如稀氢氧化钠溶液或氨水等.这样操作产生的主要问题是______;
②喷洒Zn(C2H5)2.Zn(C2H5)2可以与水反应生成氧化锌和乙烷.用化学(离子)方程式表示该方法生成氧化锌及防止酸性腐蚀的原理______、______.
(3)现代造纸工艺常用钛白粉(TiO2)替代明矾.钛白粉的一种工业制法是以钛铁矿(主要成分为FeTiO3)为原料按下列过程进行的,请完成下列化学方程式:
①______FeTiO3+______C+______Cl2
______TiCl4+______FeCl3+______CO
②______TiCl4+______O2
______TiO2+______Cl2.
普通纸张的主要成分是纤维素,在早期的纸张生产中,常采用纸张表面涂敷明矾的工艺,以填补其表面的微孔,防止墨迹扩散.请回答下列问题:
(1)人们发现纸张会发生酸性腐蚀而变脆、破损,严重威胁纸质文物的保存.经分析检验,发现酸性腐蚀主要与造纸中涂敷明矾的工艺有关,其中的化学原理是______;为了防止纸张的酸性腐蚀,可在纸浆中加入碳酸钙等添加剂,该工艺原理的化学(离子)方程式为______.
(2)为了保护这些纸质文物,有人建议采取下列措施:
①喷洒碱性溶液,如稀氢氧化钠溶液或氨水等.这样操作产生的主要问题是______;
②喷洒Zn(C2H5)2.Zn(C2H5)2可以与水反应生成氧化锌和乙烷.用化学(离子)方程式表示该方法生成氧化锌及防止酸性腐蚀的原理______、______.
(3)现代造纸工艺常用钛白粉(TiO2)替代明矾.钛白粉的一种工业制法是以钛铁矿(主要成分为FeTiO3)为原料按下列过程进行的,请完成下列化学方程式:
①______FeTiO3+______C+______Cl2
| ||
②______TiCl4+______O2
| ||
(1)明矾中铝离子水解产生氢离子,在酸性条件下纤维素水解,使高分子链断裂,所以纸质会变脆,破损.
故答案为:明矾水解产生酸性环境,在酸性条件下纤维素水解,使高分子链断裂;CaCO3+2H+=Ca2++CO2↑+H2O;
(2)①纤维素不但能在酸性环境下水解,在碱性条件下同样水解.过量的碱同样可能会导致纤维素水解,造成书籍污损.
故答案为:过量的碱同样可能会导致纤维素水解,造成书籍污损;
②由信息可知:Zn(C2H5)2可以与水反应生成氧化锌和乙烷,其实反应原理相可看成锌结合水电离出来的氢氧根,最后变为
氧化锌和水,则C2H5结合氢变为乙烷.氧化锌可以与酸性溶液反应,从而消耗掉氢离子,起到防止腐蚀的作用.
故答案为 ②Zn(C2H5)2+H2O=ZnO+2C2H6↑;ZnO+H+=Zn2++H2O;
(3)①利用电子得失守恒法有:Cl:0→-1;Fe:+2→+3;C:0→+2
由原子守恒:TiCl4、FeCl3前系数同时乘以2,这样再根据Ti守恒与Fe守恒就可以配平该反应方程式了.
故答案为:2;6;7;2;2;6;
②根据氧气为氧化剂,1mol氧气得到2mol电子,生成1mol氯气失去1mol电子,
故答案为:1;1;1;2.
故答案为:明矾水解产生酸性环境,在酸性条件下纤维素水解,使高分子链断裂;CaCO3+2H+=Ca2++CO2↑+H2O;
(2)①纤维素不但能在酸性环境下水解,在碱性条件下同样水解.过量的碱同样可能会导致纤维素水解,造成书籍污损.
故答案为:过量的碱同样可能会导致纤维素水解,造成书籍污损;
②由信息可知:Zn(C2H5)2可以与水反应生成氧化锌和乙烷,其实反应原理相可看成锌结合水电离出来的氢氧根,最后变为
氧化锌和水,则C2H5结合氢变为乙烷.氧化锌可以与酸性溶液反应,从而消耗掉氢离子,起到防止腐蚀的作用.
故答案为 ②Zn(C2H5)2+H2O=ZnO+2C2H6↑;ZnO+H+=Zn2++H2O;
(3)①利用电子得失守恒法有:Cl:0→-1;Fe:+2→+3;C:0→+2
由原子守恒:TiCl4、FeCl3前系数同时乘以2,这样再根据Ti守恒与Fe守恒就可以配平该反应方程式了.
故答案为:2;6;7;2;2;6;
②根据氧气为氧化剂,1mol氧气得到2mol电子,生成1mol氯气失去1mol电子,
故答案为:1;1;1;2.

练习册系列答案
相关题目
【化学--选修:物质结构与性质】三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用.NF3是一种三角锥型分子,键角102°,沸点-129℃;可在铜的催化作用下由F2和过量NH3反应得到.
(1)写出制备 NF3的化学反应方程式: .
(2)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是 .
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为 .
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,则该物质的化学式为 ,其中心离子是 ,配位数为 .
(5)根据下列四种元素的第一至第四电离能数据(单位:kJ?mol-1 ),回答下面各题:
①在周期表中,最可能处于同一族的是 和 .
②T元素最可能是 区元素.若T为第二周期元素,E是第三周期元素中原子半径最小的元素,则T、E形成化合物的空间构型为 ,其中心原子的杂化方式为 .
(1)写出制备 NF3的化学反应方程式:
(2)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,则该物质的化学式为
(5)根据下列四种元素的第一至第四电离能数据(单位:kJ?mol-1 ),回答下面各题:
| 元素代号 | I1 | I2 | I3 | I4 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
②T元素最可能是
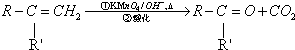 (R、R′可表示烃基或官能团)
(R、R′可表示烃基或官能团)