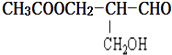��Ŀ����
����Ŀ������������Ҫ�ɷ���Al2O3 �� ��SiO2��Fe2O3��MgO�����ʣ�����ȡ�����������ֹ����������£� 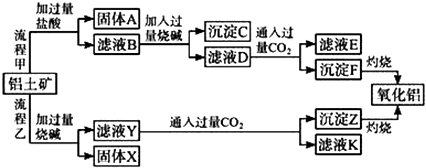
��ش��������⣺
��1����ҺY��ͨ�����CO2�����ӷ���ʽΪ�� ��
��2����֤��ҺB��Fe3+ �� ��ȡ������Һ�����������Լ����ƣ���
��3���о��������Ĺ�ҵ��;֮һ ��
��4��ָ�������ҵ�һ��ȱ���� ��
��5���������뽹̿�Ļ�����ڵ����и��¼��ȷ�Ӧ���Ƶ����ͷǽ�������AlN��һ����ѧ��������X����֪ÿת��6.02��1023�����ӣ���0.5mol������X���ɣ��˷�Ӧ�Ļ�ѧ����ʽ ��
���𰸡�
��1��SiO32��+2CO2+2H2O=H2SiO3��+2HCO3����AlO2��+CO2+2H2O=Al��OH��3��+HCO3��
��2�����軯����Һ
��3��ұ����
��4������������������
��5��Al2O3+N2+3C ![]() 2AlN+3CO
2AlN+3CO
���������⣺�ɹ������̼�֪�������������ᷴӦ�ù���AΪ��ҺB�������AΪSiO2 �� ��ҺB�����Ȼ������Ȼ������Ȼ�þ�ȣ���Һ�м��������NaOH������֪����CΪ����������������þ����ҺD����ƫ�����ơ��Ȼ���NaOH����������ҺD��ͨ�����������̼��������������������̼�����ƣ�����FΪAl��OH��3 �� ��ҺE�к���NaCl��NaHCO3�� ���ݹ��������ҿ�֪���������е�Al2O3��SiO2�ܺ��������Ʒ�Ӧ����֪����XΪFe2O3��MgO�ȣ���ҺYΪ�����ơ�ƫ�����ƣ���Һ��ͨ�����������̼������ZΪAl��OH��3�����ᣬ��ҺK�к���NaHCO3 �� ��1������ҺY��ͨ������CO2ʱ���ɵij���ZΪAl��OH��3�����ᣬ������Ӧ�����ӷ���ʽΪ��SiO32��+2CO2+2H2O=H2SiO3��+2HCO3�� �� AlO2��+CO2+2H2O=Al��OH��3��+HCO3�� ��
���Դ��ǣ�SiO32��+2CO2+2H2O=H2SiO3��+2HCO3�� �� AlO2��+CO2+2H2O=Al��OH��3��+HCO3����
��2.����֤��ҺB��Fe3+ �� ��ȡ������Һ���������軯����Һ������Һ�Ƿ��Ѫ��ɫ��
���Դ��ǣ����軯����Һ��
��3.����ҵ�ϳ��õ���������ķ���ұ������
���Դ��ǣ�ұ������
��4.����������ķ�����֪�������ҵõ�ZΪAl��OH��3�����ᣬ���ȷֽ�õ����������к��ж����������ʣ�
���Դ��ǣ��������к��ж����������ʣ�
��5.���������뽹̿�Ļ�����ڵ����и��¼��ȷ�Ӧ���Ƶ����ͷǽ�������AlN��һ����ѧ��������X������Ԫ���غ��֪X��Ӧ������Ԫ�غ�̼Ԫ�أ���֪ÿת��6.02��1023�����Ӽ�1mol���ӣ���0.5mol������X���ɣ��ɵ���ת���غ㣬�ɵ���X��C�Ļ��ϼ�Ϊ ![]() =2������X��CO�����Ը÷�Ӧ�Ļ�ѧ����ʽΪAl2O3+N2+3C
=2������X��CO�����Ը÷�Ӧ�Ļ�ѧ����ʽΪAl2O3+N2+3C ![]() 2AlN+3CO��
2AlN+3CO��
���Դ��ǣ�Al2O3+N2+3C ![]() 2AlN+3CO��
2AlN+3CO��