题目内容
(13分)纳米氧化亚铜(Cu2O)是一种用途广泛的光电材料,常用的制备方法有电化学法、湿化学法等。电化学法可用铜棒和石墨作电极,电解Cu(NO3)2稀溶液制备。湿化学法的制备过程为:在KOH溶液中加入一定量的CuSO4溶液,再加入一定量的还原剂——肼(N2H4),加热并保持温度在90℃。检验反应完全后,分离、洗涤、真空干燥得到固体样品。反应方程式为:
4CuSO4 + N2H4 + 8KOH = 2Cu2O + N2↑+ 4K2SO4 + 6H2O
⑴电化学法制备Cu2O时,铜棒做 极,阴极生成Cu2O的电极反应式为 。
⑵湿化学法中,检验纳米Cu2O已经生成的实验方法是 。
⑶湿化学法得到的产品中常含有Cu。称取某产品1.76 g(设仅含Cu2O和Cu),加入足量的稀硝酸,充分反应后得到标准状况下的NO气体224mL,计算产品中Cu2O的质量分数。(写出计算过程)
4CuSO4 + N2H4 + 8KOH = 2Cu2O + N2↑+ 4K2SO4 + 6H2O
⑴电化学法制备Cu2O时,铜棒做 极,阴极生成Cu2O的电极反应式为 。
⑵湿化学法中,检验纳米Cu2O已经生成的实验方法是 。
⑶湿化学法得到的产品中常含有Cu。称取某产品1.76 g(设仅含Cu2O和Cu),加入足量的稀硝酸,充分反应后得到标准状况下的NO气体224mL,计算产品中Cu2O的质量分数。(写出计算过程)
⑴阳极(2分) 2Cu2+ + 2e-+ H2O ="=" Cu2O+2H+ (2分)
⑵丁达尔效应(或详细叙述操作)(2分)
⑶(3)根据质量可知n(Cu2O) · 144mol·L—1 + n(Cu) · 64mol·L—1 ="1.76" g。根据电子得失守恒可知n(Cu2O) · 2 + n(Cu) · 2 =" 0.224/22.4" mol ×3。解得n(Cu2O)=" 0.01" mol、n(Cu)="0.005" mol。所以氧化亚铜的质量分数为w(Cu2O) =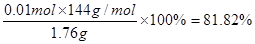 。
。
⑵丁达尔效应(或详细叙述操作)(2分)
⑶(3)根据质量可知n(Cu2O) · 144mol·L—1 + n(Cu) · 64mol·L—1 ="1.76" g。根据电子得失守恒可知n(Cu2O) · 2 + n(Cu) · 2 =" 0.224/22.4" mol ×3。解得n(Cu2O)=" 0.01" mol、n(Cu)="0.005" mol。所以氧化亚铜的质量分数为w(Cu2O) =
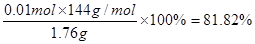 。
。(1)要生成氧化亚铜,则铜必须失去电子,因此铜作阳极。阴极得到电子,发生还原反应,所以阴极电极反应式为2Cu2+ + 2e-+ H2O ="=" Cu2O+2H+。
(2)氧化亚铜的直径是纳米级,所以属于胶体,因此通过丁达尔效应检验即可。
(3)根据质量可知n(Cu2O) · 144mol·L—1 + n(Cu) · 64mol·L—1 ="1.76" g。根据电子得失守恒可知n(Cu2O) · 2 + n(Cu) · 2 =" 0.224/22.4" mol ×3。解得n(Cu2O)=" 0.01" mol、n(Cu)="0.005" mol。所以氧化亚铜的质量分数为w(Cu2O) =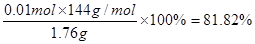 。
。
(2)氧化亚铜的直径是纳米级,所以属于胶体,因此通过丁达尔效应检验即可。
(3)根据质量可知n(Cu2O) · 144mol·L—1 + n(Cu) · 64mol·L—1 ="1.76" g。根据电子得失守恒可知n(Cu2O) · 2 + n(Cu) · 2 =" 0.224/22.4" mol ×3。解得n(Cu2O)=" 0.01" mol、n(Cu)="0.005" mol。所以氧化亚铜的质量分数为w(Cu2O) =
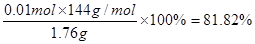 。
。
练习册系列答案
相关题目
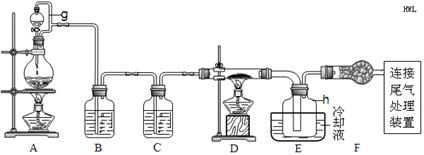
 5Fe3++Mn2++4H2O
5Fe3++Mn2++4H2O
 始沉淀时的pH
始沉淀时的pH 。(填序号)
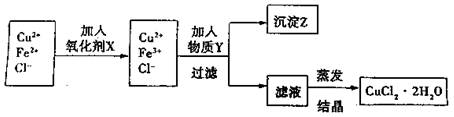
。(填序号) ++H2↑设计实验来制取CuCl2溶液,该同学设计的装置应该为 。(填“原电池”或“电解池”)
++H2↑设计实验来制取CuCl2溶液,该同学设计的装置应该为 。(填“原电池”或“电解池”)