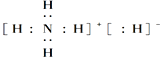题目内容
【题目】按要求书写
(1)氨气的电子式:_________,乙炔的结构简式:___________;
(2)工业上利用乙烯催化水化法制取乙醇,化学反应方程式:________反应类型:____________
(3)苯与浓硝酸在50~60℃下发生硝化反应:________反应类型:_____________;
(4)已知键能如下:
化学键 | H—H | N—N | N—H | N≡N |
键能kJ/mol | 432 | 247 | 389 | 942 |
写出N2和H2合成NH3的热化学方程式:_____________。
【答案】![]() CH≡CH CH2=CH2+H2O
CH≡CH CH2=CH2+H2O![]() CH3CH2OH 加成
CH3CH2OH 加成 ![]() +HNO3
+HNO3![]()
![]() +H2O 取代 N2(g)+3H2(g)
+H2O 取代 N2(g)+3H2(g)![]() 2NH3(g);△H=-96kJ/mol
2NH3(g);△H=-96kJ/mol
【解析】
(1)N原子与3个H原子形成3个共价键;乙炔分子中2个C原子形成3个共价键,每个C原子与H原子形成1个共价键;
(2)乙烯与水发生加成反应制取乙醇;
(3)苯与浓硝酸在50~60℃下发生取代反应才硝基苯和水;
(4)根据反应热为断键吸收热量与成键放出热量的差计算。
(1)N原子最外层有5个电子,有三个成单电子分别与3个H原子形成3个共价键,所以NH3的电子式为![]() ;乙炔分子中2个C原子之间形成3个共价键,每个C原子与1个H原子形成1个共价键,因此乙炔的乙炔的结构简式为CH≡CH;
;乙炔分子中2个C原子之间形成3个共价键,每个C原子与1个H原子形成1个共价键,因此乙炔的乙炔的结构简式为CH≡CH;
(2)乙烯与水在催化剂存在和加热时发生加成反应产生乙醇,反应方程式为:CH2=CH2+ H2O ![]() CH3CH2OH,反应类型为加成反应;
CH3CH2OH,反应类型为加成反应;
(3)苯与浓硝酸在50~60℃下发生取代反应才硝基苯和水,反应方程式为:![]() +HNO3
+HNO3![]()
![]() +H2O,反应类型为取代反应;
+H2O,反应类型为取代反应;
(4)N2与H2合成氨气的反应方程式为N2+3H2![]() 2NH3;根据反应热的含义为断裂反应物的化学键吸收热量与形成生成物的化学键放出热量的差,可知该反应的反应热为942+3×432-6×389=-96kJ/mol,所以该反应的热化学方程式为N2(g)+3H2(g)
2NH3;根据反应热的含义为断裂反应物的化学键吸收热量与形成生成物的化学键放出热量的差,可知该反应的反应热为942+3×432-6×389=-96kJ/mol,所以该反应的热化学方程式为N2(g)+3H2(g)![]() 2NH3(g);△H=-96kJ/mol。
2NH3(g);△H=-96kJ/mol。

 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案【题目】为解决能源短缺问题,工业生产中应合理利用化学能。
(1)25℃,1.01×105Pa时,实验测得,4g氢气在O2中完全燃烧生成液态水,放出572kJ的热量,则表示H2的燃烧热的热化学方程式为________________________________。
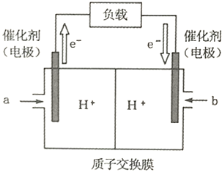
(2)下图是某笔记本电脑使用的甲醇燃料电池的结构示意图。放电时甲醇应从_________处通入(填“a”或“b”),电池内部H+向_________(填“左”或“右”)移动。写出电池负极的电极反应式_________________________________。
(3)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。
化学键 | H-H | N-H | N≡N |
键能/ kJ·mol-1 | 436 | a | 945 |
已知:N2(g)+3H2(g)=2NH3(g) △H=-93 kJ·mol-1。试根据表中所列键能数据计算a的数值__________。
(4)已知:C(s,石墨)+O2(g)=CO2(g) △H1=-393.5 kJ·mol-1 ①
2H2(g)+O2(g)=2H2O(1) △H2=-571.6 kJ·mol-1 ②
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(1) △H3=-2599 kJ·mol-1 ③
根据盖斯定律,计算反应2C(s,石墨)+H2(g)=C2H2(g)的△H=_______________。