题目内容
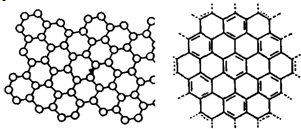 美国《科学》杂志评出的2009年十大科学突破之一是石墨烯的研究和应用方面的突破.石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性.制备石墨烯方法有石墨剥离法、化学气相沉积法等.石墨烯的球棍模型及分子结构示意图如右图:
美国《科学》杂志评出的2009年十大科学突破之一是石墨烯的研究和应用方面的突破.石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性.制备石墨烯方法有石墨剥离法、化学气相沉积法等.石墨烯的球棍模型及分子结构示意图如右图:(1)下列有关石墨烯说法正确的是
BD
BD
.A.石墨烯的结构与金刚石相似
B.石墨烯分子中所有原子可以处于同一平面
C.12g石墨烯含σ键数为NA
D.从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合.
①钴原子在基态时,核外电子排布式为:
[Ar]3d74s2
[Ar]3d74s2
.②乙醇沸点比氯乙烷高,主要原因是
乙醇分子间可形成氢键,而氯乙烷分子间无氢键
乙醇分子间可形成氢键,而氯乙烷分子间无氢键
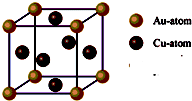
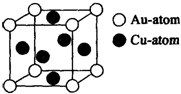
.③右图是金与铜形成的金属互化物合金,它的化学式可表示为:
Cu3Au或AuCu3
Cu3Au或AuCu3
.
④含碳源中属于非极性分子的是
a、b、c
a、b、c
(a.甲烷 b.乙炔 c.苯 d.乙醇).
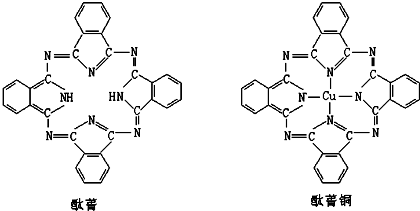
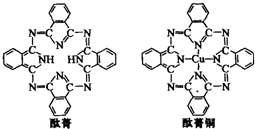
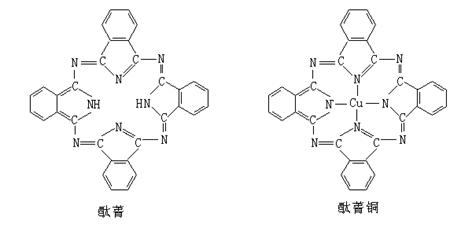
⑤酞菁与酞菁铜染料分子结构如下图,酞菁分子中氮原子采用的杂化方式有:
sp3和sp2
sp3和sp2
;酞菁铜分子中心原子的配位数为:2
2
.
分析:(1)根据石墨烯的结构分析,石墨烯是一种平面结构,根据一个碳原子含有的σ键判断12g石墨烯中含有的σ键个数;石墨中每层碳原子和每层碳原子之间存在作用力.
(2)①根据构造原理书写钴原子在基态时的核外电子排布式.
②根据氢键对物质熔沸点的影响分析.
③利用均摊法确定化学式.
④根据分子的根据构型判断,以极性键结合的多原子分子如结构对称,正负电荷的重心重合,电荷分布均匀,则为非极性分子.
⑤由结构式中的键和孤电子对数判断氮原子采用的杂化方式;根据结构直接去寻找与其相邻的原子并结合化学式去确定.
(2)①根据构造原理书写钴原子在基态时的核外电子排布式.
②根据氢键对物质熔沸点的影响分析.
③利用均摊法确定化学式.
④根据分子的根据构型判断,以极性键结合的多原子分子如结构对称,正负电荷的重心重合,电荷分布均匀,则为非极性分子.
⑤由结构式中的键和孤电子对数判断氮原子采用的杂化方式;根据结构直接去寻找与其相邻的原子并结合化学式去确定.
解答:解:(1)A、石墨烯是平面结构,金刚石空间网状结构,故A错误.
B.碳碳双键上所有原子都处于同一平面,所以导致石墨烯分子中所有原子可以处于同一平面,故B正确.
C.石墨烯中一个碳原子具有1.5个σ键,所以12g石墨烯含σ键数为1.5NA,故C错误.
D.石墨结构中,石墨层与层之间存在分子间作用力,所以从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力
,故D正确.
故选BD.
(2)①钴是27号元素,钴原子核外有27个电子,根据构造原理书写基态原子的核外电子排布式,注意向排4s电子再排3d电子,所以基态钴原子的核外电子排布式为[Ar]3d74s2.
故答案为[Ar]3d74s2.
②分子晶体中,物质的熔沸点随着相对分子质量的增大而增大,但乙醇分子间能形成氢键导致乙醇的熔沸点大于氯乙烷的熔沸点.
故答案为:乙醇分子间可形成氢键,而氯乙烷分子间无氢键.
③每个晶胞中含有的铜原子数=
×6=3,含有的金原子数=
×8=1,所以它的化学式可表示为:Cu3Au或AuCu3.
故答案为Cu3Au或AuCu3.
④a.甲烷是正四面体结构,属于对称结构,所以是非极性分子.
b.乙炔是直线型结构,属于对称结构,所以是非极性分子.
c.苯是平面结构,属于对称结构,所以是非极性分子.
d.乙醇不是对称结构,所以是极性分子.
故选a、b、c.
⑤酞菁分子中部分氮原子含有2个σ键一个孤对电子,所以采取sp2杂化,部分氮原子含有3个σ键一个孤对电子,所以采取
sp3杂化.
该分子中能提供孤对电子的氮原子才是配原子,所以酞菁铜分子中心原子的配位数为:2.
故答案为:sp3和sp2; 2.
B.碳碳双键上所有原子都处于同一平面,所以导致石墨烯分子中所有原子可以处于同一平面,故B正确.
C.石墨烯中一个碳原子具有1.5个σ键,所以12g石墨烯含σ键数为1.5NA,故C错误.
D.石墨结构中,石墨层与层之间存在分子间作用力,所以从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力
,故D正确.
故选BD.
(2)①钴是27号元素,钴原子核外有27个电子,根据构造原理书写基态原子的核外电子排布式,注意向排4s电子再排3d电子,所以基态钴原子的核外电子排布式为[Ar]3d74s2.
故答案为[Ar]3d74s2.
②分子晶体中,物质的熔沸点随着相对分子质量的增大而增大,但乙醇分子间能形成氢键导致乙醇的熔沸点大于氯乙烷的熔沸点.
故答案为:乙醇分子间可形成氢键,而氯乙烷分子间无氢键.
③每个晶胞中含有的铜原子数=
| 1 |
| 2 |
| 1 |
| 8 |
故答案为Cu3Au或AuCu3.
④a.甲烷是正四面体结构,属于对称结构,所以是非极性分子.
b.乙炔是直线型结构,属于对称结构,所以是非极性分子.
c.苯是平面结构,属于对称结构,所以是非极性分子.
d.乙醇不是对称结构,所以是极性分子.
故选a、b、c.
⑤酞菁分子中部分氮原子含有2个σ键一个孤对电子,所以采取sp2杂化,部分氮原子含有3个σ键一个孤对电子,所以采取
sp3杂化.
该分子中能提供孤对电子的氮原子才是配原子,所以酞菁铜分子中心原子的配位数为:2.
故答案为:sp3和sp2; 2.
点评:本题考查了物质结构知识,难度较大,注意形成配位键的本质、配位数的确定方法和确定中心原子的杂化类型,这些都是高考的重点.

练习册系列答案
相关题目
[化学—选修物质结构与性质](15分)
美国《科学》杂志评出的2009年十大科学突破之一是石墨烯的研究和应用方面的突破。石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性。制备石墨烯方法有石墨剥离法、化学气相沉积法等。石墨烯的球棍模型及分子结构示意图如右: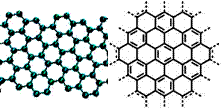
(1)下列有关石墨烯说法正确的是____。
| A.石墨烯的结构与金刚石相似 |
| B.石墨烯分子中所有原子可以处于同一平面 |
| C.12g石墨烯含σ键数为NA |
| D.从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力 |
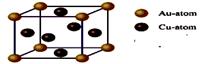
①钴原子在基态时,核外电子排布式为:____________。
②乙醇沸点比氯乙烷高,主要原因是____________。
③上图是金与铜形成的金属互化物合金,它的化学式可表示为:________。
④含碳源中属于非极性分子的是___(a.甲烷 b.乙炔 c.苯 d.乙醇)
⑤酞菁与酞菁铜染料分子结构如下图,酞菁分子中氮原子采用的杂化方式有:________。
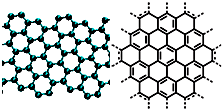 A.美国《科学》杂志评出的2009年十大科学突破之一是石墨烯的研究和应用方面的突破.石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性.制备石墨烯方法有石墨剥离法、化学气相沉积法等.石墨烯的球棍模型及分子结构示意图如右:
A.美国《科学》杂志评出的2009年十大科学突破之一是石墨烯的研究和应用方面的突破.石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性.制备石墨烯方法有石墨剥离法、化学气相沉积法等.石墨烯的球棍模型及分子结构示意图如右: