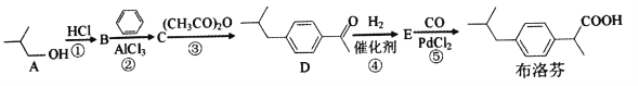
题目内容
【题目】氯及其化合物在生产、生活中有广泛的应用。请按照要求回答下列问题。
I.化合物A在一定条件下通过电解所得产品及其之间的反应如下图所示

(1)写出反应①离子方程式___________________。
(2)溶液G中还应有的溶质化学式为___________________。
II. 以氯酸钠(NaClO3)为原料制备亚氯酸钠(NaClO2)粗品的工艺流程如下图所示:

已知:i.纯ClO2易分解爆炸,空气中ClO2的体积分数在10%以下比较安全;
ii.NaClO2在碱性溶液中稳定存在,在酸性溶液中迅速分解;
iii.NaClO2饱和溶液在温度低于38℃时析出NaClO23H2O,等于或高于38℃时析出NaC1O2晶体,高 于60℃时分解成NaClO3和NaCl。
(1)试剂A应选择_______。(填字母)
a.浓硝酸 b. Na2SO3溶液 c. KMnO4溶液
(2)反应②的离子方程式为_______。
(3)已知压强越大,物质的沸点越高。反应②结束后采用“减压蒸发”操作的原因是_____。
(4)反应①进行过程中应持续鼓入空气,其目的是_______。
(5)系列操作依次是_______(写明条件和名称)、过滤、洗涤,最后在________条件下进行干燥,得到粗产品NaClO2。
【答案】 ![]() NaCl b 2OH-+ClO2+H2O2=2ClO2-+O2+2H2O 减压可以使物质沸点降低,实验较低温度下进行蒸发,可避免NaClO2 因温度高而发生分解 稀释ClO2 以防止爆炸 冷却结晶 低于60℃下
NaCl b 2OH-+ClO2+H2O2=2ClO2-+O2+2H2O 减压可以使物质沸点降低,实验较低温度下进行蒸发,可避免NaClO2 因温度高而发生分解 稀释ClO2 以防止爆炸 冷却结晶 低于60℃下
【解析】试题分析:I.B单质焰色呈黄色,B是Na;C是黄绿色气体,C是氯气;所以A是NaCl;电解氯化钠溶液生成氢氧化钠、氢气、氯气,所以D是NaOH、E是H2;根据氧化还原反应升降规律,氯气和氢氧化钠溶液反应生成NaClO3的同时还生成NaCl;II. (1) NaClO3发生还原反应生成ClO2;(2) 反应②是 ClO2、H2O2、NaOH反应生成ClO2-、O2 ;(3) 高于60℃时NaClO2分解成NaClO3和NaCl,需要在较低温度下进行蒸发,减压可以使物质沸点降低;(4) 纯ClO2易分解爆炸,空气中ClO2的体积分数在10%以下比较安全;(5)NaClO2饱和溶液在温度低于38℃时析出NaClO23H2O,等于或高于38℃时析出NaC1O2晶体,高于60℃时分解成NaClO3和NaCl。
解析:I. (1)根据以上分析,反应①是电解氯化钠溶液,离子方程式是![]() ;(2) 根据氧化还原反应升降规律,氯气和氢氧化钠溶液反应生成NaClO3的同时还生成NaCl,所以溶液G中还应有的溶质为NaCl;II. (1) NaClO3发生还原反应生成ClO2,浓硝酸、KMnO4具有氧化性,Na2SO3具有还原性,所以试剂A是Na2SO3,故选b;(2) 反应②是 ClO2、H2O2、NaOH反应生成ClO2-、O2,反应离子方程式是2OH-+ClO2+H2O2=2ClO2-+O2+2H2O;(3) 高于60℃时NaClO2分解成NaClO3和NaCl,减压可以使物质沸点降低,实验较低温度下进行蒸发,可避免NaClO2 因温度高而发生分解;(4) 纯ClO2易分解爆炸,空气中ClO2的体积分数在10%以下比较安全,持续鼓入空气的目的是稀释ClO2 以防止爆炸;(5)NaClO2饱和溶液在温度低于38℃时析出NaClO23H2O,等于或高于38℃时析出NaC1O2晶体,高于60℃时分解成NaClO3和NaCl,所以系列操作依次是冷却结晶、过滤、洗涤,最后在低于60℃下条件下进行干燥,得到粗产品NaClO2。
;(2) 根据氧化还原反应升降规律,氯气和氢氧化钠溶液反应生成NaClO3的同时还生成NaCl,所以溶液G中还应有的溶质为NaCl;II. (1) NaClO3发生还原反应生成ClO2,浓硝酸、KMnO4具有氧化性,Na2SO3具有还原性,所以试剂A是Na2SO3,故选b;(2) 反应②是 ClO2、H2O2、NaOH反应生成ClO2-、O2,反应离子方程式是2OH-+ClO2+H2O2=2ClO2-+O2+2H2O;(3) 高于60℃时NaClO2分解成NaClO3和NaCl,减压可以使物质沸点降低,实验较低温度下进行蒸发,可避免NaClO2 因温度高而发生分解;(4) 纯ClO2易分解爆炸,空气中ClO2的体积分数在10%以下比较安全,持续鼓入空气的目的是稀释ClO2 以防止爆炸;(5)NaClO2饱和溶液在温度低于38℃时析出NaClO23H2O,等于或高于38℃时析出NaC1O2晶体,高于60℃时分解成NaClO3和NaCl,所以系列操作依次是冷却结晶、过滤、洗涤,最后在低于60℃下条件下进行干燥,得到粗产品NaClO2。

【题目】)蛇纹石矿由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁实验步骤如下:

已知:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 1.5 | 3.3 | 9.4 |
(1)蛇纹石加盐酸溶解后,溶液里除了Mg2+外,还含有的阳离子有________________。
(2)进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见上表),Ca(OH)2不能过量,若Ca(OH)2过量可能会导致________溶解、________沉淀。
(3)物质循环使用,能节约资源,上述实验中,可以循环使用的物质是______________。
(4)高温煅烧碱式碳酸镁aMgCO3·bMg(OH)2·cH2O得到MgO。取碱式碳酸镁4.66 g,高温煅烧至恒重,得到固体2.00 g和标准状况下CO2 0.896 L,通过计算确定碱式碳酸镁的化学式为 ____________________。(写出计算过程,否则不得分)