题目内容
12.下列分子中的中心原子杂化轨道的类型相同的是( )| A. | CO2与SO2 | B. | CH4与NH3 | C. | BeCl2与BF3 | D. | C2H4与C2H2 |
分析 根据VSEPR理论和杂化轨道理论判断分子的空间构型和中心原子的杂化方式,据此分析解答.
解答 解:A.CO2,根据VSEPR理论,配位原子数为BP=2,孤电子对数为LP=$\frac{4-2×2}{2}$=0,则价电子对数为VP=BP+LP=2+0=2,根据杂化轨道理论,中心C原子为sp杂化,SO2,根据VSEPR理论,配位原子数为BP=2,孤电子对数为LP=$\frac{6-2×2}{2}$=1,则价电子对数为VP=BP+LP=2+1=3,根据杂化轨道理论,中心S原子为sp2杂化,二者中心原子的杂化轨道类型不同,故A不选;
B.CH4分子中,C成四个共价键,中心C原子为sp3杂化,NH3,根据VSEPR理论,配位原子数为BP=3,孤电子对数为LP=$\frac{5-1×3}{2}$=1,则价电子对数为VP=BP+LP=3+1=4,根据杂化轨道理论,中心N原子为sp3杂化,二者中心原子的杂化轨道类型相同,故B选;
C.BeCl2,根据VSEPR理论,配位原子数为BP=2,孤电子对数为LP=$\frac{2-1×2}{2}$=0,则价电子对数为VP=BP+LP=2+0=2,根据杂化轨道理论,中心Be原子为sp杂化,BF3,根据VSEPR理论,配位原子数为BP=3,孤电子对数为LP=$\frac{3-1×3}{2}$=0,则价电子对数为VP=BP+LP=3+0=3,根据杂化轨道理论,中心B原子为sp2杂化,二者中心原子的杂化轨道类型不同,故C不选;
D.C2H4为乙烯,分子构型为平面型,C原子为sp2杂化,C2H2为乙炔,分子构型为直线型,C原子为sp杂化,二者分子中的中心原子杂化轨道类型不相同,故D不选.
故选B.
点评 本题考查价层电子对互斥理论和杂化轨道理论判断分子的构型,杂化轨道类型,本题难度不大,是基础题.

| A. | 液氨可用作制冷剂 | B. | SO2广泛用于食品漂白 | ||
| C. | 铁制容器可用于存储浓硝酸 | D. | 浓硫酸不能用来干燥氨气 |
| A. | 羟基的电子式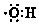 | B. | 醛基的结构简式-COH | ||
| C. | 2-丁烯的键线式  | D. | 2-丙醇的结构简式 C3H7-OH |

| A. | 太阳能、风能、潮汐能 | B. | 水能、生物质能、天然气 | ||
| C. | 煤炭、生物质能、沼气 | D. | 地热能、石油、核能 |
| A. | 标准状况下,2.24L戊烷所含分子数为0.1 NA | |
| B. | 78gNa2O2固体与足量的H2O反应转移的电子数为0.5NA | |
| C. | 17.6g丙烷中所含的极性共价键为4NA个 | |
| D. | 2.0gH218O和D216O的混合物中所含中子数为NA |
| A. | 双氧水 | B. | 四氯化碳 | C. | 氮气 | D. | 二氧化碳  |


