题目内容
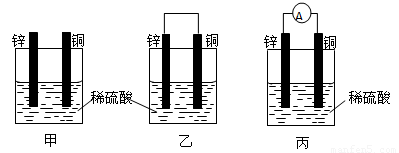
(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上有气泡,再平行插入一块铜片,可观察到铜片上
(2)如果烧杯中最初装入的是500mL 2mol?L-1的稀硫酸,构成铜锌原电池(假设产生的气体没有损失),当在标准状况下收集到11.2L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度应为(溶液体积变化忽略不计)
没有
没有
(填“有”或“没有”)气泡产生,再用导线把锌片和铜片连接起来,组成一个原电池,负极为锌片
锌片
,正极的电极反应式为2H++2e-═H2↑
2H++2e-═H2↑
.(2)如果烧杯中最初装入的是500mL 2mol?L-1的稀硫酸,构成铜锌原电池(假设产生的气体没有损失),当在标准状况下收集到11.2L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度应为(溶液体积变化忽略不计)
c(H2SO4)=1mol?L-1,c(ZnSO4)=1mol?L-1
c(H2SO4)=1mol?L-1,c(ZnSO4)=1mol?L-1
.分析:(1)铜不活泼,与硫酸不反应,锌和铜形成原电池时,锌为负极,铜为正极,正极上生成氢气;
(2)当在标准状况下收集到11.2L的氢气时,硫酸剩余,电解质为硫酸和硫酸锌,结合电极方程式计算.
(2)当在标准状况下收集到11.2L的氢气时,硫酸剩余,电解质为硫酸和硫酸锌,结合电极方程式计算.
解答:解:(1)铜片插入稀硫酸中时,二者不反应,没有气泡产生,但当把铜片和锌片用导线相连插入稀硫酸中时,会构成原电池,铜作为原电池正极,电极反应为2H++2e-═H2↑,锌作为原电池负极,电极反应为Zn-2e-═Zn2+,电池总反应为Zn+2H+═Zn2++H2↑,故答案为:没有;锌片;2H++2e-═H2↑;
(2)当收集到11.2L H2(标准状况),即0.5mol H2时,消耗的H2SO4为0.5mol,生成的ZnSO4为0.5mol,
c(H2SO4)=
=1mol?L-1,c(ZnSO4)=
=1mol?L-1.
故答案为:c(H2SO4)=1mol?L-1,c(ZnSO4)=1mol?L-1.
(2)当收集到11.2L H2(标准状况),即0.5mol H2时,消耗的H2SO4为0.5mol,生成的ZnSO4为0.5mol,
c(H2SO4)=
| 0.5L×2mol?L-1-0.5mol |
| 0.5L |
| 0.5mol |
| 0.5L |
故答案为:c(H2SO4)=1mol?L-1,c(ZnSO4)=1mol?L-1.
点评:本题考查原电池知识,侧重于学生的基础知识的综合运用和计算能力的考查,注意把握原电池的工作原理以及电极方程式的书写,学习中注意体会,难度不大.

练习册系列答案
相关题目


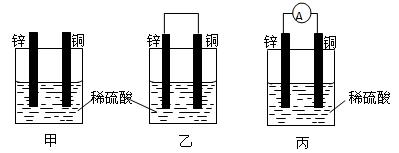
 人们把它叫做原电池。
人们把它叫做原电池。