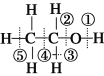
题目内容
【题目】已知A是一种常见金属,F是一种红褐色沉淀。试根据图中转化关系,回答下列问题。

(1)A的原子序数为26,A元素在周期表中的位置:______,写出NaOH 的电子式:_____。
(2)写出检验D中阳离子的操作方法为_________________________。
(3)保存C溶液时要加固体A的原因是______________。
(4)写出下列转化的方程式:
①B→C的离子方程式:______________________________。
②E→F的化学方程式:_______________________________。
【答案】第四周期第Ⅷ族 ![]() 取D溶液少许于试管中,加入几滴KSCN溶液,溶液变红色,证明含Fe3+ 防止Fe2+被O2氧化 Fe3O4 +8H+ = Fe2+ +2 Fe3+ + 4H2O 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
取D溶液少许于试管中,加入几滴KSCN溶液,溶液变红色,证明含Fe3+ 防止Fe2+被O2氧化 Fe3O4 +8H+ = Fe2+ +2 Fe3+ + 4H2O 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
【解析】
F是红褐色沉淀,即F为Fe(OH)3,A是一种常见金属,结合框图中物质的转化,从而推知A为Fe,B为Fe3O4,C为FeCl2,D为FeCl3,E为Fe(OH)2,G为Fe2O3,X为H2;
F是红褐色沉淀,即F为Fe(OH)3,A是一种常见金属,结合框图中物质的转化,从而推知A为Fe,B为Fe3O4,C为FeCl2,D为FeCl3,E为Fe(OH)2,G为Fe2O3,X为H2;
(1)A为26号元素,且A为Fe,Fe元素在周期表中的位置:第四周期Ⅷ族;NaOH为离子化合物,含有离子键和共价键,即NaOH电子式为![]() ;
;
(2)D为FeCl3,检验Fe3+常用KSCN,即操作步骤是取D溶液少量于试管中,加入几滴KSCN溶液,溶液变为(血)红色,证明含Fe3+;
(3)C为FeCl2,Fe2+容易被氧化成Fe3+,且2Fe3++Fe=3Fe2+,因此保存FeCl2溶液加铁屑的原因是防止Fe2+被O2氧化;
(4)①Fe3O4与盐酸反应的离子方程式为Fe3O4+8H+=Fe2++2Fe3++4H2O;
②Fe(OH)2→Fe(OH)3,其化学反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。

【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下[已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1]:
2NH3(g) ΔH=-92.4 kJ·mol-1]:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1 mol N2、3 mol H2 | 2 mol NH3 | 4 mol NH3 |
NH3的浓度(mol·L-1) | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
下列说法正确的是
A. 2c1>c3 B. a+b=92.4 C. 2p2<p3 D. α1+α3>1