题目内容
2.SiC和CO2物质中的化学键均为共价键,SiC的熔点高且硬度大,而CO2的晶体干冰却松软而且极易汽化.由此可判断,CO2是分子晶体,而SiC可能是原子晶体.分析 一般来说原子晶体熔点高、硬度大,而分子晶体的熔点低、硬度小,以此解答该题.
解答 解:CO2的晶体干冰却松软而且极易汽化,应为分子晶体,SiC的熔点高且硬度大,为原子晶体,故答案为:分子;原子.
点评 本题考查晶体的类型的判断,为高频考点,侧重考查学生分析能力和对基础知识的应用能力,注意把握常见晶体的性质,难度不大.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
12.下列叙述错误的是( )
| A. | 与  互为同分异构体的芳香族化合物有6种 互为同分异构体的芳香族化合物有6种 | |
| B. | 含有5个碳原子的某饱和链烃,其一氯取代物的结构可能有3种 | |
| C. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,得到的结构可能有6种 | |
| D. | 菲的结构简式为 ,它与硝酸反应,可生成5种一硝基取代物 ,它与硝酸反应,可生成5种一硝基取代物 |
13. 的同分异构体中,某苯环上的一氯代物只有一种的结构有(不考虑立体异构)( )
的同分异构体中,某苯环上的一氯代物只有一种的结构有(不考虑立体异构)( )
 的同分异构体中,某苯环上的一氯代物只有一种的结构有(不考虑立体异构)( )
的同分异构体中,某苯环上的一氯代物只有一种的结构有(不考虑立体异构)( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
10.除第一周期外,关于同周期主族元素的下列变化规律的叙述中不正确的是( )
| A. | 从左到右,原子半径逐渐减小 | |
| B. | 从左到右,元素原子的得电子能力减弱,失电子能力增强 | |
| C. | 从左到右,气态氢化物的稳定性增强 | |
| D. | 从左到右,元素最高价氧化物对应水化物碱性减弱,酸性增强 |
17.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 100 mL 0.1 mol•L-1 K2SO4溶液中,含有氧原子数为0.04NA | |
| B. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA | |
| C. | 25℃时,1.0 L pH=13的Ba(OH)2溶液中,含有的OH-数目为0.2NA | |
| D. | 100 g 17%的氨水中,含有氨分子数为NA |
7.下列说法正确的是( )
| A. | 将0.10 mol•L-1氨水加水稀释后,溶液中c(NH4+)•c(OH-)变大 | |
| B. | 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 | |
| C. | 将CH3COOH溶液加水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$变大 | |
| D. | 用0.200 0 mol•L-1NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合溶液中两种酸的浓度均为0.1 mol•L-1),至中性时,溶液中的酸未被完全中和 |
14.下列有关化学用语表达不正确的是( )
| A. | CO2的电子式: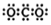 | |
| B. | CS2分子的结构式:S=C=S | |
| C. | S2-的结构示意图: | |
| D. | 8个中子的碳原子的核素符号:${\;}_6^{14}C$ |
12.下列说法正确的是( )
| A. | 水可以用来分离溴苯和苯的混合物 | |
| B. | 淀粉和纤维素互为同分异构体 | |
| C. | 环己烷与苯可用酸性KMnO4溶液鉴别 | |
| D. | 植物油氢化过程中发生了加成反应 |
 合理应用和处理氮的化合物,在生产生活中有重要意义.
合理应用和处理氮的化合物,在生产生活中有重要意义.