题目内容
【题目】已知烃B分子内C、H原子个数比为1︰2,相对分子质量为28,核磁共振氢谱显示分子中只有一种化学环境的氢原子,且有如下的转化关系:
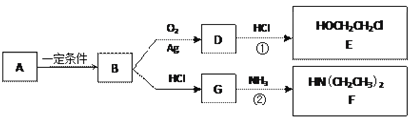
(1)B的结构简式是_________________
(2)A可能属于下列哪类物质___________
a.醇 b.卤代烃 c.酚 d.羧酸
(3)反应①是D与HCl按物质的量之比1︰1的加成反应,则D的分子式是___________。
反应②可表示为:G + NH3→ F + HCl (未配平),该反应配平后的化学方程式是(有机化合物均用结构简式表示): ____________________________________
化合物E(HOCH2CH2Cl)和 F [ HN(CH2CH3)2 ]是药品普鲁卡因合成的重要中间体,普鲁卡因的合成路线如下:(已知:![]() )
)
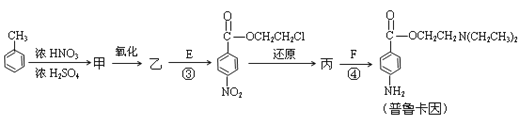
(4)甲的结构简式是 _________________。
由甲苯生成甲的反应类型是_________________。
(5)乙中有两种含氧官能团,反应③的化学方程式是___________________________________
(6)丙中官能团的名称是_______________________________________。
(7)普鲁卡因有两种水解产物丁和戊。
① 戊与甲互为同分异构体,戊的结构简式是_____________________。
② 戊经聚合反应制成的高分子纤维广泛用于通讯、宇航等领域。该聚合反应的化学方程式是__________________________________________。
③ D的红外光谱表明分子内除C—H键、C—C键外还含有两个C—O单键。则D与F在一定条件下反应生成丁的化学方程式是________________________________。
【答案】CH2=CH2 ab C2H4O 2CH3CH2Cl + NH3→NH(CH2CH3)2 +2HCl ![]() 取代反应(或硝化反应)
取代反应(或硝化反应) ![]() +HOCH2CH2Cl
+HOCH2CH2Cl![]()
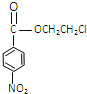 +H2O 酯基、氯原子、氨基
+H2O 酯基、氯原子、氨基 ![]()
![]()
![]()
【解析】
烃B分子内C、H原子个数比为1:2,相对分子质量为28,令B的分子式为CnH2n,则14n=28,解得n=2,核磁共振氢谱显示分子中只有一种化学环境的氢原子,则B为CH2=CH2,A可能为卤代烃或醇,发生消去反应生成乙烯,B→D发生氧化反应,反应①是D与HCl按物质的量之比1:1的加成反应,E的结构简式为HOCH2CH2Cl,D的分子式为C2H4O;B与HCl发生加成反应生成G,G为CH3CH2Cl,G与氨气发生取代反应生成F,据此解答。
由普鲁卡因的合成路线可以知道,甲苯发生硝化反应生成的甲为![]() ,甲发生氧化反应生成的乙为
,甲发生氧化反应生成的乙为![]() ,乙与E发生酯化反应生成
,乙与E发生酯化反应生成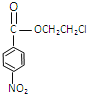 ,
,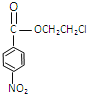 中硝基被还原为氨基生成的丙为
中硝基被还原为氨基生成的丙为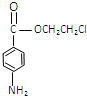 ,丙与F发生取代反应生成普鲁卡因,然后结合物质的性质来解答。
,丙与F发生取代反应生成普鲁卡因,然后结合物质的性质来解答。
烃B分子内C、H原子个数比为1:2,相对分子质量为28,令B的分子式为CnH2n,则14n=28,解得n=2,核磁共振氢谱显示分子中只有一种化学环境的氢原子,则B为CH2=CH2,A可能为卤代烃或醇,发生消去反应生成乙烯,B→D发生氧化反应,反应①是D与HCl按物质的量之比1:1的加成反应,E的结构简式为HOCH2CH2Cl,D的分子式为C2H4O;B与HCl发生加成反应生成G,G为CH3CH2Cl,G与氨气发生取代反应生成F;
由普鲁卡因的合成路线可以知道,甲苯发生硝化反应生成的甲为![]() ,甲发生氧化反应生成的乙为
,甲发生氧化反应生成的乙为![]() ,乙与E发生酯化反应生成
,乙与E发生酯化反应生成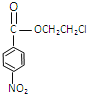 ,
,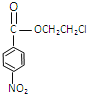 中硝基被还原为氨基生成的丙为
中硝基被还原为氨基生成的丙为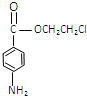 ,丙与F发生发生取代反应生成普鲁卡因;
,丙与F发生发生取代反应生成普鲁卡因;
(1)由上述分析可以知道,B的结构简式为CH2=CH2;
(2)A发生消去反应生成乙烯,则A可能为卤代烃或醇,故选:ab;
(3)反应①是D与HCl按物质的量之比1:1的加成反应,E的结构简式为HOCH2CH2Cl,则D的分子式为C2H4O ;反应②为2CH3CH2Cl+NH3→NH(CH2CH3)2+2HCl;
(4)由上述分析可以知道,甲为对硝基甲苯,结构简式为![]() ;由甲苯生成甲的反应类型是取代反应(或硝化反应);
;由甲苯生成甲的反应类型是取代反应(或硝化反应);
(5)乙为![]() ,含有的官能团为羧基、硝基,反应③的反应方程式为:
,含有的官能团为羧基、硝基,反应③的反应方程式为:![]() +HOCH2CH2Cl
+HOCH2CH2Cl![]()
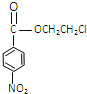 +H2O;
+H2O;
(6)丙为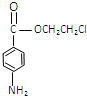 ,其中含有官能团的名称是酯基、氯原子、氨基;
,其中含有官能团的名称是酯基、氯原子、氨基;
(7)①普鲁卡因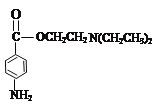 的水解产物有两种,分别是:
的水解产物有两种,分别是:![]() 、HOCH2CH2N(CH2CH3)2,其中
、HOCH2CH2N(CH2CH3)2,其中![]() 和
和![]() 互为同分异构体,则戊的结构简式为
互为同分异构体,则戊的结构简式为![]() ;
;
②![]() 中氨基和羧基发生缩聚反应,生成
中氨基和羧基发生缩聚反应,生成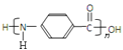 ,该聚合反应的化学方程式是
,该聚合反应的化学方程式是 ![]() ;
;
③D的分子式为C2H4O,D的红外光谱表明分子内除C—H键、C—C键外还含有两个C—O单键,D的结构简式为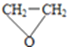 ,D与F在一定条件下反应生成丁[HOCH2CH2N(CH2CH3)2]的化学方程式是
,D与F在一定条件下反应生成丁[HOCH2CH2N(CH2CH3)2]的化学方程式是![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行了探究。已知在不同温度下的化学平衡常数(K1、K2、K3)如表所示。
化学反应 | 焓变 | 平衡 常数 | 温度/℃ | ||
500 | 700 | 800 | |||
①2H2(g)+CO(g) | ΔH1 | K1 | 2.5 | 0.34 | 0.15 |
②CO2(g)+H2(g) | ΔH2 | K2 | 1.0 | 1.70 | 2.52 |
③CO2(g)+3H2(g) | ΔH3 | K3 | |||
请回答下列问题:
(1)反应②是________(填“吸热”或“放热”)反应。
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=________(用K1、K2表示);根据反应③判断ΔS________(填“>”“=”或“<”)0,在________(填“较高”或“较低”)温度下有利于反应自发进行。
(3)要使反应③在一定条件下建立的平衡逆向移动,可采取的措施有________(填字母,后同)。
A.缩小反应容器的容积 B.增大反应容器的容积
C.升高温度 D.使用合适的催化剂 E.从平衡体系中及时分离出CH3OH
(4)500 ℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1 mol·L-1、0.8 mol·L-1、0.3 mol·L-1、0.15 mol·L-1,则此时v(正)________v(逆)(填“>”“=”或“<”)。