题目内容
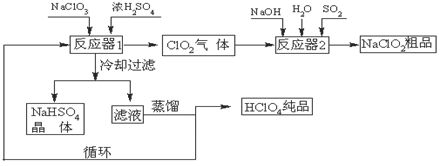
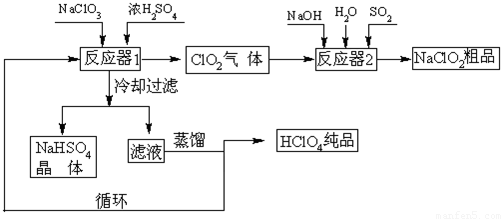
工业上生产高氯酸(沸点:90°C)时还同时生产了亚氯酸钠,其工艺流程如下:
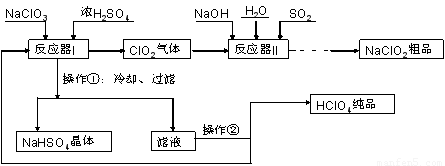
(1)实验室进行过滤操作的常用玻璃仪器有???????????? 。
(2)反应器I中的温度最佳为???????? (填序号);操作②的名称为????????? 。
A. 0°C ;????????? B. 20°C ;??????? C. 80°C ;????????? D. 120°C??
(3)反应器II中发生反应的离子方程式为?????????????? 。
(4)加快反应器II中反应速率的措施有?????????????? (写出一种措施即可)等。从反应器II中获得NaClO2?? 粗品的实验操作依次是???????? (填序号,下同),进一步提纯的操作名称为???????? 。
A.过滤? B.重结晶? C.蒸馏? D.蒸发浓缩? E.蒸干灼烧? F.冷却结晶? G.萃取分液
(5)上述流程中可循环使用的物质为???????? ,副产品除NaClO2、NaHSO4外还有???????? (填化学式)。
(1)(普通)漏斗、玻璃棒、烧杯(3分,各1分)
(2)C; 蒸馏 (各1分)
(3)2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O?? (2分)
(4)适当升高温度(增大NaOH溶液的浓度、增大气体(SO2、ClO2)和NaOH溶液的接触面积等)(2分);DF(A)(2分);B(1分)
(5)硫酸;Na2SO4 (各2分)
【解析】
试题分析: (1)实验室常用的玻璃仪器有(普通)漏斗、玻璃棒、烧杯,做题的时候容易写不全,所以在作答时联想实验时的情境,从下往上想不容易出错。
(2)反应器I中加入的氯酸钠在浓硫酸的作用下发生了氧化还原反应,Cl化合价+4←+5→+7,因此得到的含氯化合物中有ClO2 气体和高氯酸,所以要得到较高浓度的高氯酸溶液,应该尽可能的升温使ClO2 气体溢出,同时温度不能过高,超过高氯酸沸点温度90°C容易使高氯酸气化,所以最佳温度应该选C,80°C。而在后一阶段的滤液中再获得纯净的高氯酸产品,可以选择蒸馏,升高温度至高氯酸沸点温度,蒸馏得到高氯酸纯品。
(3)从反应II的前后反应物和产物可以看出,Cl的化合价+4→+3,发生了氧化还原反应,ClO2 气体做氧化剂, SO2在反应中被氧化为了SO42-,有碱参与反应生成盐和水,所以根据氧化还原得失电子守恒进行缺项配平,可得反应的离子方程式为2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O。(4)影响反化学应速率的因素有温度、浓度、接触面积等,所以在反应器II中要加快反应速率,可以通过适当升高温度、或增大氢氧化钠的浓度、气体与溶液的接触面积等措施来改变。若要从从反应器II中获得NaClO2 晶体粗品,可以通过蒸发浓缩、冷却结晶、过滤的方法得到,故选DFA;进一步提纯粗品晶体,则应该对该粗产品进行重结晶处理。
(5)上述流程分为2个生产方向,在生产高氯酸的环节中,蒸馏得到高氯酸纯品剩下的溶液为硫酸溶液,所以硫酸溶液可以循环到反应器I中加以利用;而在生产副产品NaClO2中还生成了有Na2SO4,所以副产品共有NaClO2、NaHSO4、Na2SO4 。
考点:本题考查的是化学工艺流程题,设计几个简单实验内容、氧化还原反应方程式配平等内容。

 工业上生产高氯酸(沸点:90°C)时还同时生产了亚氯酸钠,其工艺流程如下:
工业上生产高氯酸(沸点:90°C)时还同时生产了亚氯酸钠,其工艺流程如下: