题目内容
(14分)长期存放的Na2SO3,会被空气中的氧气部分氧化。某化学兴趣小组通过实验测定某无水Na2SO3,被氧化的程度。
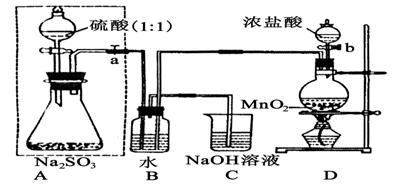
(Ⅰ)甲同学设计了下图实验。

请回答:
(1)写出B装置中反应的离子方程式 ;
(2)写出D装置中反应的化学方程式 ;
(3)若起始实验时称量出放入锥形瓶中Na2SO3样品质量为a g,实验后向B装置的溶液中加入足量BaCl2溶液充分反应,过滤、洗涤、干燥、称量得白色沉淀b g,则样品中Na2SO3的质量分数为 ;
(4)深入研究发现,上述实验方案存在缺陷,致使测得的Na2SO3,质量分数偏小,试分析其中的原因(列出一条即可) 。
(Ⅱ)乙同学设计了另一套实验装置如下图:
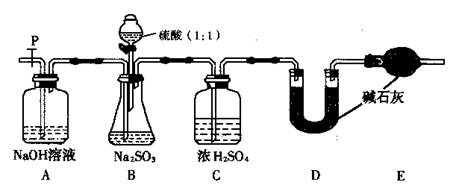
(5)实验中待锥形瓶中不再产生气体后,打开活塞P从导管左端缓缓鼓入一定量的空气,这样做的目的是 ;
(6)除已称量的a g Na2SO3,样品外,实验中还应测定的数据是 处(填图中字母)装置实验前后的质量差。
(Ⅲ)现有以下试剂:蒸馏水、盐酸、稀硝酸、BaCl2溶液、Ba(NO3)2溶液。
(7)丙同学欲从中选择合适试剂,来测定已知质量为ag的Na2SO3,样品中Na2SO3的质量分数,下述实验方案理论上可行的有 。
A. 将样品溶解,加足量盐酸,再加足量BaCl2溶液,过滤、洗涤、干燥、称量得沉淀m
B.将样品溶解,加足量硝酸,再加足量BaCl2溶液,过滤、洗涤、干燥、称量得沉淀m2 g
C.将样品溶解,加过量BaCl2溶液,过滤后,将滤液蒸干,称量得固体m3 g
D.将样品溶解,加过量Ba(NO3)2溶液,过滤、洗涤,在沉淀中加入足量盐酸,再过滤、洗涤、于燥、称量得固体m4 g
(1)4HCl(浓)+MnO2=MnCl2+Cl2+2H2O
(2)SO2+Cl2+2H2O=SO42-+2Cl-+4H+
(3)126b/233a
(4)锥形瓶和导管中的SO2未全部排入广口瓶中与Cl2反应,或产生SO2速度太快没完全与Cl2反应而排入到氢氧化钠溶液中。
(5)将装置中的SO2全部排入U形管中被吸收
(6)D
(7)ABD

 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
 元索,
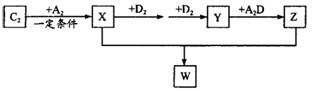
元索,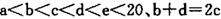 。A2为常温常压下密度最小的气体,B的单质有多种同素异形体,其中一种为质软灰黑色固体。C的最外层电子数是电子层数的2. 5倍。用E的单质制作的餐具不宜长期存放酸性、碱性或咸味食物。
。A2为常温常压下密度最小的气体,B的单质有多种同素异形体,其中一种为质软灰黑色固体。C的最外层电子数是电子层数的2. 5倍。用E的单质制作的餐具不宜长期存放酸性、碱性或咸味食物。
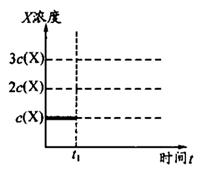
 元索,
元索, 。A2为常温常压下密度最小的气体,B的单质有多种同素异形体,其中一种为质软灰黑色固体。C的最外层电子数是电子层数的2. 5倍。用E的单质制作的餐具不宜长期存放酸性、碱性或咸味食物。
。A2为常温常压下密度最小的气体,B的单质有多种同素异形体,其中一种为质软灰黑色固体。C的最外层电子数是电子层数的2. 5倍。用E的单质制作的餐具不宜长期存放酸性、碱性或咸味食物。