题目内容
铅蓄电池属于二次电池。下图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液。电池反应为:Pb+PbO2+4H++2SO42— 2PbSO4+2H2O
2PbSO4+2H2O
下列有关说法正确的是
| A.实验室用铅蓄电池作电源电解饱和食盐水制取氯气,若制得氯气2.24L,则电池内消耗的H2SO4的物质的量是0.2mol |
| B.K与N相接时,H+向正极区迁移 |
| C.K与M连接时,所用电源的b极为负极 |
| D.K与M相接时,阳极附近的pH逐渐增大 |
B
解析试题分析:A、由于铅蓄电池电能和化学能转化时存在损耗,因此当制得2.24L氯气时,消耗硫酸的物质的量至少是0.2mol,错误;B、当K与N相接时,装置为原电池,则H+向正极区迁移,正确;
C、K与M连接时,装置为电解池,b极为正极,错误;D、K与M连接时,阳极发生反应:PbSO4+2H2O -2e= PbO2+4H++SO42-,因此阳极附近pH减小,错误。
考点:本题考查了电化学的知识,要求学生能掌握电极反应方程式的书写和电子转移判断。

练习册系列答案
相关题目
根据图示判断下列叙述符合事实的是
| A.按图①连接并放置一段时间后,Fe片表面会“镀”上一层铜 |
| B.按图②连接好导线后(Zn片与Cu片相接触),灵敏电流表会发生非常明显的偏转 |
| C.按图③连接并放置片刻,在Fe片附近加一滴KSCN溶液,溶液变为深红色 |
| D.按图④连接并放置一段时间后,在Sn片上有无色气泡聚集 |
对如图所示的实验装置的判断中错误的是
| A.若X为碳棒,开关K置于A处可减缓铁的腐蚀 |
| B.若X为锌棒,开关K置于A或B处均可减缓铁的腐蚀 |
| C.若X为锌棒,开关K置于B处时,为牺牲阳极的阴极保护法 |
| D.若X为碳棒,开关K置于B处时,铁电极上发生的反应为2H++2e→H2↑ |
锌、铁、镁、铝、锂等金属都可以用在金属燃料电池中,电池的基本结构如图所示。下列说法正确的是
| A.电池工作时,电子沿M→电解液→Y电极流动 |
| B.若M为铝,溶液的pH将不断变大 |
| C.若M为镁,电池总的化学方程式为2Mg+O2=2MgO |
| D.若M为铁,则负极的电极反应式为Fe—2e—=Fe2+ |
用酸性氢氧燃料电池为电源进行电解的实验装置如下图所示。下列说法正确的是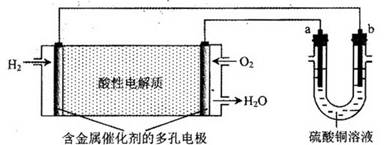
| A.燃料电池工作时,正极反应为:O2+2H2O+4e-=4OH- |
| B.若a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出 |
| C.若a、b极都是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等 |
| D.若a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 |
用铂电极电解下列溶液时,在阳极上有气体放出,且溶液的PH下降的是( )
| A.KNO3溶液 | B.HCl溶液 | C.NaOH溶液 | D.CuSO4溶液 |
下图是酸性燃料电池酒精检测仪,两电极材料均为Pt。下列说法正确的是( )
| A.X极发生还原反应 |
| B.每生成0.6克CH3COOH,电子转移为0.04 mol |
| C.Y极反应方程式为:O2+4e-+2H2O=4OH— |
| D.质子移向X极 |
按如图装置进行实验(N装置中两个电极均为石墨棒),下列描述正确的是( )
| A.a、b未连接时,装置N中C1电极上有气体析出 |
| B.不论a、b是否连接,装置M中观察到的实验现象相同 |
| C.a、b连接,工作一段时间后装置M中溶液pH变大,装置N中溶液pH变小 |
| D.a、b连接,装置M中若有0.1mol SO42-移到Cu电极,装置N中C2极放出 H22.24 L(标准状况) |
下列说法正确的是

| A.图①铜锌原电池工作时,盐桥中的K+移向ZnSO4溶液 |
| B.图②装置反应一段时间,将湿润的KI淀粉试纸靠近碳电极管口,试纸变蓝 |
| C.图③是用海水制取蒸馏水的装置 |
| D.图④装置可用于乙醇提取碘水中的碘 |