题目内容
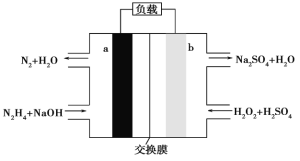
【题目】用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示。下列推断正确的是 ( )

A.a极应与电源的负极相连
B.膜1为阴离子交换膜,膜2为阳离子交换膜
C.a极的电极反应式为2H2O一4e一=4H++O2↑
D.若收集22.4L的P(标准状况下),则转移4mol电子
【答案】A
【解析】
A.a电极上稀NaOH溶液转化为浓NaOH溶液,过程中OH-浓度增大,a电极发生反应:2H2O+2e-═2OH-+H2↑,说明a电极为阴极,应与外电路负极相连,故A正确;
B.b电极上稀硫酸转化为浓硫酸,过程中SO42-的量增大,则是由SO32-转化得到,发生反应SO32--2e-+H2O═SO42-+2H+,则膜2应为阴离子交换膜,a电极上稀NaOH溶液转化为浓NaOH溶液,过程中OH-浓度增大,则发生电极反应2H2O+2e-═2OH-+H2↑,膜1应为阳离子交换膜,故A错误;
C.a电极上稀NaOH溶液转化为浓NaOH溶液,过程中OH-浓度增大,且反应有气体产生,则应发生的电极反应式为:2H2O+2e-═2OH-+H2↑,故C错误;
D.a电极发生电极反应为:2H2O+2e-═2OH-+H2↑,若收集22.4LP(标准状况下),即收集H2的标况下的物质的量为![]() =1mol,根据电极反应,则转移电子数为2mol,故D错误;
=1mol,根据电极反应,则转移电子数为2mol,故D错误;
故答案为A。

 阅读快车系列答案
阅读快车系列答案【题目】一定温度下,在3个体积均为l.0L的恒容密闭容器中反应2H2(g)+CO(g)![]() CH3OH(g)分别达到平衡。下列说法正确的是
CH3OH(g)分别达到平衡。下列说法正确的是
容器 | 温度(K) | 起始浓度(mol/L) | CH3OH平衡浓度(mol/L) | ||
H2 | CO | CH3OH | |||
① | 400 | 0.20 | 0.10 | 0 | 0.08 |
② | 400 | 0.40 | 0.20 | 0 | X |
③ | 500 | 0 | 0 | 0.10 | 0.025 |
A. 该反应的正反应是吸热反应
B. X=0.16
C. 平衡时,容器②中H2的体积分数比容器①的大
D. 400K时若再向容器①中充入0.10molH2、0.10molCO和0.10molCH3OH,则平衡将向正反应方向移动
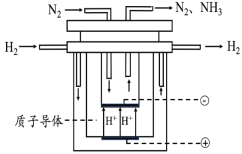
【题目】合成氨对人类的生存和发展有着重要意义,1909年哈伯在实验室中首次利用氮气与氢气反应合成氨,实现了人工固氮。
(1)反应N2(g)+3H2(g)![]() 2NH3(g)的化学平衡常数表达式为_____。
2NH3(g)的化学平衡常数表达式为_____。
(2)请结合下列数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因是______。
序号 | 化学反应 | K(298K)的数值 |
① | N2(g)+O2(g) | 5×10-31 |
② | N2(g)+3H2(g) | 4.1×106 |
(3)对于反应N2(g)+3H2(g)![]() 2NH3(g),在一定条件下氨的平衡含量如下表。
2NH3(g),在一定条件下氨的平衡含量如下表。
温度/℃ | 压强/MPa | 氨的平衡含量 |
200 | 10 | 81.5% |
550 | 10 | 8.25% |
①该反应为______(填“吸热”或“放热”)反应。
②哈伯选用的条件是550℃、10MPa,而非200℃、10MPa,可能的原因是______。
(4)一定温度下,在容积恒定的密闭容器中充入1mol氮气和3mol氢气,一段时间后达化学平衡状态。若保持其他条件不变,向上述平衡体系中再充入1mol氮气和3mol氢气,氮气的平衡转化率______(填“变大”“变小”或“不变”)。
(5)尽管哈伯的合成氨法被评为“20世纪科学领域中最辉煌的成就”之一,但仍存在耗能高、产率低等问题。因此,科学家在持续探索,寻求合成氨的新路径。如图为电解法合成氨的原理示意图,阴极的电极反应式为______。