题目内容
下列装置适用于实验室制氨气并验证氨气的某化学性质,其中能达到实验目的的是( )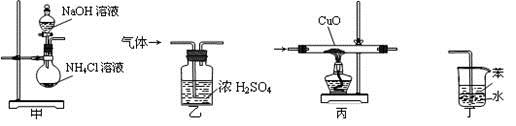
A. 用装置甲制取氨气 B. 用装置乙除去氨气中的水蒸气
C. 用装置丙验证氨气具有还原性 D. 用装置丁吸收尾气
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
题目内容
下列装置适用于实验室制氨气并验证氨气的某化学性质,其中能达到实验目的的是( )
A. 用装置甲制取氨气 B. 用装置乙除去氨气中的水蒸气
C. 用装置丙验证氨气具有还原性 D. 用装置丁吸收尾气
 阅读快车系列答案
阅读快车系列答案