题目内容
【题目】在一容积为2L的密团容器内加入0.2molN2和0.6molH2,在一定条件下发生如下反应: ![]() N2(g)+
N2(g)+ ![]() H2(g)
H2(g)![]() NH3(g)
NH3(g)
①该反应的平衡常数的表达式是:____________。
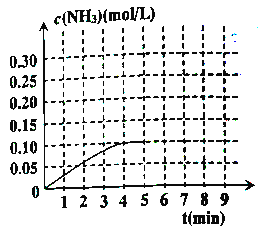
②反应中氨气的浓度的变化情况如图所示,计算从反应开始到平衡时,平均反应速率v(H2)=________。
③判断该反应达到平衡状态的标志是_________。
a.N2和NH3浓度相等 b.NH3百分含量保持不变
c.容器中气体的压强保持不变 d.NH3的生成速率与H2的消耗速率相等
e.容器中混合气体的密度保持不变
④反应达平衡后,第5分钟末,保持其它条件不变,仅改变反应温度,则NH3的物质的量浓度不可能为______。
a.0.2mol/L b.0.12mol/L c.0.10mol/L d.0.08mol/L
⑤在第5分钟末,将容器体积缩小一半后,若在第8分钟末达到新平衡(此时NH3浓度约为0.25mol/L),请在上图中画出从第5分钟末开始,再达到新平衡时NH3浓度变化曲线。______________
【答案】  0.0375mol/(L·min) b c a c
0.0375mol/(L·min) b c a c 
【解析】①平衡常数可以用生成物平衡浓度的幂次方乘积除以反应物平衡浓度的幂次方乘积得到;该反应的平衡常数的表达式是: ;②△n(NH3)=0.1mol·L-1×2L=0.2mol
;②△n(NH3)=0.1mol·L-1×2L=0.2mol
N2+3H2![]() 2NH3
2NH3
n始/mol 0.2 0.6
n变/mol 0.1 0.3 0.2
n平/mol 0.1 0.3 0.2
v(H2)= ![]() = 0.0375mol/(L·min)
= 0.0375mol/(L·min)
③a.N2和NH3浓度相等,无法确定各组分的浓度是否改变,故不符;b.NH3百分含量保持不变,说明正逆反应速率相等,故相符;c.反应前后气体物质的量不相同,过程中和平衡状态下压强不变,容器内的压强不再变化,能说明反应达到平衡状态,故符合;d.NH3的生成速率与H2的消耗速率相等均为正确速率,故不符;e.容器中混合气体的密度保持不变,从开始到平衡始终不变。故不符;故选b c;(4)改变反应温度,平衡一定移动,而氮气和氢气不可能完全转化为氨气,所以c(NH3)<0.20mol·L-1,a. 如果氨气的浓度是0.20mol·L-1,则氮气与氢气完全转化,故错误;b.降低温度,氨气的浓度可能为0.12mol·L-1,故正确;c.温度改变,平衡一定移动,所以不可能为0.10mol·L-1,故错误;d.升高温度,平衡逆向移动,所以氨气浓度变小,可能为:0.08mol·L-1,故正确;故选:ac;⑤把容器的体积缩小一半的瞬间氨气的浓度,氨气的浓度变为0.20mol·L-1,平衡后浓度约为0.3mol·L-1,所以第5分钟末到此平衡时NH3浓度的变化曲线为: 。
。

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案