题目内容
某研究性学习小组研究HNO3的氧化性,设计了如下实验:在盛有新配制FeS04溶液的试管中滴入2滴KSCN溶液,观察现象,然后再滴人几滴浓HN 03,溶液的颜色变红,但是将红色溶液放置一会儿则发现溶液由红色突然变为蓝色,并产生红棕色气体。这一奇 特现象激起了同学的好奇心与求知欲望,对此现象设计了探究性实验。
(1)实验室粗略配制一定质量分数的硫酸亚铁溶液的方法是:将一定质量的绿矾(FeS04·7H2 0)置于烧杯中,__________________________。
(2)提出假设:
甲同学认为是FeS04与HN03作用
乙同学认为是KSCN与HNO3作用
(3)根据乙同学的观点,设计了如下实验方案进行验证:向浓HN03中逐滴加入KSCN溶液,实验开始时无明显现象,一段时间后溶液慢慢变红色至深红色,突然剧烈反应产生大量气泡,放出红棕色气体。继续滴入KSCN,溶液变为浅蓝色,最后变成无色。将产生的气体通人过量的Ba(OH)2溶液,产生浑浊,并剩余一种气体(该气体是空气中的主要成分之一);向反应后的溶液中加入BaC12溶液产生白色沉淀。
写出向浓HNO3中滴入KSCN溶液反应的离子方程式:__________________
丙同学认为还应设计K2S04溶液与浓硝酸作用的实验,他的理由是__________________
(4)延伸探究:丁同学认为SCN-的性质还应进一步探究,查资料发现:(SCN)2是一种“拟卤素”,与C12、Br2有相似的性质。他据此设计了以下方案:向Fe(SCN)3中分别滴加过量的氯水、溴水,溶液的红色均变为黄色。请写出Fe(SCN)3与氯气反应的离子方程式: 。
(5)通过本次探究,可以得出以下结论:
a、用SCN -间接检验Fe2+时加入氧化剂应注意 (填“少量”、“过量”);
b、与SCN-反应使溶液变红的不一定是Fe3+
(1)实验室粗略配制一定质量分数的硫酸亚铁溶液的方法是:将一定质量的绿矾(FeS04·7H2 0)置于烧杯中,__________________________。
(2)提出假设:
甲同学认为是FeS04与HN03作用
乙同学认为是KSCN与HNO3作用
(3)根据乙同学的观点,设计了如下实验方案进行验证:向浓HN03中逐滴加入KSCN溶液,实验开始时无明显现象,一段时间后溶液慢慢变红色至深红色,突然剧烈反应产生大量气泡,放出红棕色气体。继续滴入KSCN,溶液变为浅蓝色,最后变成无色。将产生的气体通人过量的Ba(OH)2溶液,产生浑浊,并剩余一种气体(该气体是空气中的主要成分之一);向反应后的溶液中加入BaC12溶液产生白色沉淀。
写出向浓HNO3中滴入KSCN溶液反应的离子方程式:__________________
丙同学认为还应设计K2S04溶液与浓硝酸作用的实验,他的理由是__________________
(4)延伸探究:丁同学认为SCN-的性质还应进一步探究,查资料发现:(SCN)2是一种“拟卤素”,与C12、Br2有相似的性质。他据此设计了以下方案:向Fe(SCN)3中分别滴加过量的氯水、溴水,溶液的红色均变为黄色。请写出Fe(SCN)3与氯气反应的离子方程式: 。
(5)通过本次探究,可以得出以下结论:
a、用SCN -间接检验Fe2+时加入氧化剂应注意 (填“少量”、“过量”);
b、与SCN-反应使溶液变红的不一定是Fe3+
(1)加入适量的稀硫酸,用玻璃棒搅拌,(再加水稀释,)最后加入少量铁粉(或铁屑)
(3)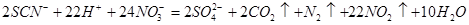
对照实验(验证硫酸钾与浓硝酸是否反应)。
(4)
(5)少量
(3)
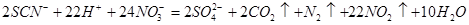
对照实验(验证硫酸钾与浓硝酸是否反应)。
(4)

(5)少量
试题分析:(1)实验室粗略配制一定质量分数的硫酸亚铁溶液的方法是:将一定质量的绿矾(FeS04·7H2 0)置于烧杯中,加入适量的稀硫酸,用玻璃棒搅拌,(再加水稀释,)最后加入少量铁粉(或铁屑,这是为了防止亚铁离子被氧化);(3)突然剧烈反应产生大量气泡,放出红棕色气体,该气体为二氧化氮,通入过量的Ba(OH)2溶液,产生浑浊,并剩余一种气体(该气体是空气中的主要成分之一),说明了含有硫酸根离子,该气体为氮气,并且可以判断出碳元素被转化为二氧化碳,所以向浓HNO3中滴入KSCN溶液反应的离子方程式为
 ;设计K2S04溶液与浓硝酸作用的实验作为对照实验(验证硫酸钾与浓硝酸是否反应);(4)向Fe(SCN)3中分别滴加过量的氯水、溴水,溶液的红色均变为黄色,说明生成了(SCN)2,所以与氯气反应的离子方程式为:
;设计K2S04溶液与浓硝酸作用的实验作为对照实验(验证硫酸钾与浓硝酸是否反应);(4)向Fe(SCN)3中分别滴加过量的氯水、溴水,溶液的红色均变为黄色,说明生成了(SCN)2,所以与氯气反应的离子方程式为: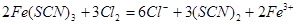 ,所以用SCN -间接检验Fe2+时加入氧化剂应注意少量,与SCN-反应使溶液变红的不一定是Fe3+。
,所以用SCN -间接检验Fe2+时加入氧化剂应注意少量,与SCN-反应使溶液变红的不一定是Fe3+。点评:本题以铁离子的检验的实验为模型,结合实验过程中出现的试剂问题,设计了一个探究性的实验,本题有利于培养学生的探究性思维,本题综合性好,有一定的难度。

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
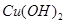 悬浊液
悬浊液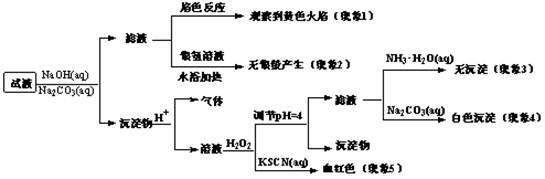
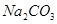 溶液,充分振荡静置后,分液
溶液,充分振荡静置后,分液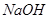 溶液,充分振荡静置后,分液
溶液,充分振荡静置后,分液 A. B. C. D.
A. B. C. D.