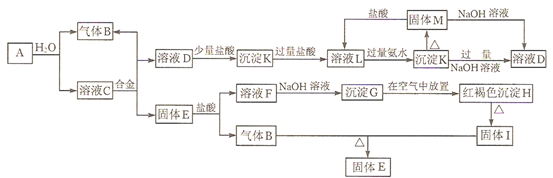
题目内容
16.设NA表示阿伏加德罗常数,下列说法中正确的是( )| A. | 1mol某气体的体积为22.4L,该气体的状况不一定是标准状况 | |
| B. | 1 mol H2O中含有的质子数为9NA | |
| C. | 2.4g镁由原子变为离子时,失电子为0.1NA | |
| D. | 将1mol CO2气体变成固体,其所含的分子数小于NA |
分析 A、根据pV=nRT可知,1mol气体的体积为22.4L,所处的条件有很多,不一定是标准状况;
B、1个水分子中含有10个电子;
C、依据n=$\frac{m}{M}$计算物质的量,结合镁原子最外层电子数为2计算;
D、1mol任何物质含有分子数为NA.
解答 解:A、1mol气体的体积为22.4L,根据pV=nRT可知,满足条件的T、P很多,不一定是标准状况,故A正确;
B、依据水分子含10个电子,1 mol H2O中含有的质子数为10NA,故B错误;
C、依据n=$\frac{m}{M}$计算物质的量=$\frac{2.4g}{24g/mol}$=0.1mol,结合镁原子最外层电子数为2计算镁由原子变为离子时,失电子为0.2NA,故C错误;
D、1mol任何物质含有分子数为NA,将1mol CO2气体变成固体,其所含的分子数等于NA,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积的条件分析判断,物质结构的理解应用,掌握基础是解题关键,题目较简单.

练习册系列答案
相关题目
4.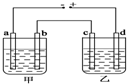 甲、乙两个相同的电解槽,如图所示连接a,b,c,d均为铂电极,通电后发现a极板处有气体放出,c极板质量增加,则以下说法中正确的是( )
甲、乙两个相同的电解槽,如图所示连接a,b,c,d均为铂电极,通电后发现a极板处有气体放出,c极板质量增加,则以下说法中正确的是( )
 甲、乙两个相同的电解槽,如图所示连接a,b,c,d均为铂电极,通电后发现a极板处有气体放出,c极板质量增加,则以下说法中正确的是( )
甲、乙两个相同的电解槽,如图所示连接a,b,c,d均为铂电极,通电后发现a极板处有气体放出,c极板质量增加,则以下说法中正确的是( )| A. | 甲槽中溶液是H2SO4,乙槽中溶液是NaOH | |
| B. | 甲槽中溶液是NaOH,乙槽中溶液是AgNO3 | |
| C. | 甲槽中溶液是AgNO3,乙槽中溶液是CuSO4 | |
| D. | 甲槽中溶液是CuSO4,乙槽中溶液是H2SO4 |
11.下列说法正确的是( )
①22.4L氧气中一定含有NA个氧分子
②将80gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度是2mol/L
③18g水在标准状况下的体积为22.4L
④在常温常压下,20mLNH3和60mL氧气所含 分子数之比为1:3.
①22.4L氧气中一定含有NA个氧分子
②将80gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度是2mol/L
③18g水在标准状况下的体积为22.4L
④在常温常压下,20mLNH3和60mL氧气所含 分子数之比为1:3.
| A. | ①②③④ | B. | ①②④ | C. | ②③ | D. | ④ |
5.下列四位同学对“NH4Cl”的认识中,不正确的是( )
| A. | 甲同学认为氯化铵由N、H、Cl三种元素组成 | |
| B. | 乙同学认为一个氯化铵分子中含有一个NH4+和一个Cl- | |
| C. | 丙同学认为氯化铵由NH4+和Cl-构成 | |
| D. | 丁同学认为氯化铵中阴、阳离子个数比为1:1 |
6.下表为元素周期表的一部分,根据表中所列出的元素回答下列问题
(1)最不活泼的元素是Ar(填元素符号),最活泼的非金属元素是F(填元素符号)
(2)可做半导体材料的元素是硅(填元素名称)
(3)氧离子结构示意图为 ,①、②、③原子半径从大到小的顺序是①②③
,①、②、③原子半径从大到小的顺序是①②③
(4)与水反应最剧烈的金属单质是Na(填元素符号),其反应的化学方程式是2Na+2H2O=2NaOH+H2↑
(5)既能与强酸又能与强碱反应的金属单质是Al(填元素符号)
(6)最高价氧化物的水化物中酸性最强的酸是HClO4写化学式)
(7)气态氢化物的稳定性:H2S<HCl(填“>”、“=”或“<”=;
(8)Al2O3中氧元素质量分数为47.1%.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(2)可做半导体材料的元素是硅(填元素名称)
(3)氧离子结构示意图为
 ,①、②、③原子半径从大到小的顺序是①②③
,①、②、③原子半径从大到小的顺序是①②③(4)与水反应最剧烈的金属单质是Na(填元素符号),其反应的化学方程式是2Na+2H2O=2NaOH+H2↑
(5)既能与强酸又能与强碱反应的金属单质是Al(填元素符号)
(6)最高价氧化物的水化物中酸性最强的酸是HClO4写化学式)
(7)气态氢化物的稳定性:H2S<HCl(填“>”、“=”或“<”=;
(8)Al2O3中氧元素质量分数为47.1%.
 A、B、C、D分别是由两种短周期元素组成的常见微粒(或粒子),这四种微粒中均含有相同数目的电子,且共含有三种元素,其中A中含有5个原子核,它们之间有如下的反应关系.
A、B、C、D分别是由两种短周期元素组成的常见微粒(或粒子),这四种微粒中均含有相同数目的电子,且共含有三种元素,其中A中含有5个原子核,它们之间有如下的反应关系. 、D
、D .
.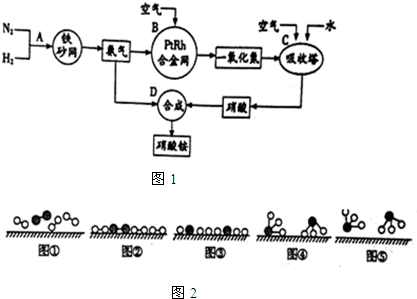
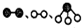 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面;在催化剂表面N2、H2中的化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面;在催化剂表面N2、H2中的化学键断裂.