题目内容
一定温度下的密闭容器中存在如下反应:CO(g)+H2O(g)  CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经10min后反应达平衡时,测定该反应在该温度下的平衡常数K=1,试判断:
CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经10min后反应达平衡时,测定该反应在该温度下的平衡常数K=1,试判断:
(1) 用H2O(g)表示该反应的反应速率?
(2)达到平衡时,CO的转化率为多少?
 CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经10min后反应达平衡时,测定该反应在该温度下的平衡常数K=1,试判断:
CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经10min后反应达平衡时,测定该反应在该温度下的平衡常数K=1,试判断:(1) 用H2O(g)表示该反应的反应速率?
(2)达到平衡时,CO的转化率为多少?
(1)0.1mol/(L·min) (2) 50%
考查可逆反应的有关计算。
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度(mol/L) 2 2 0 0
转化浓度(mol/L) x x x x
平衡浓度(mol/L)(2-x) (2-x) x x
则根据平衡常数表达式可知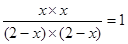
解得x=1mol/L
所以水蒸气的反应速率是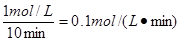
CO的转化率是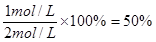
CO(g)+H2O(g)
 CO2(g)+H2(g)
CO2(g)+H2(g)起始浓度(mol/L) 2 2 0 0
转化浓度(mol/L) x x x x
平衡浓度(mol/L)(2-x) (2-x) x x
则根据平衡常数表达式可知
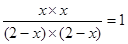
解得x=1mol/L
所以水蒸气的反应速率是
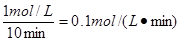
CO的转化率是
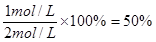

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 C(g)+D(g),当下列物理量不发生变化时,能表明该反应一定达到平衡状态的是( )
C(g)+D(g),当下列物理量不发生变化时,能表明该反应一定达到平衡状态的是( ) Sn(s,白) ΔH=+2.1 kJ/mol,△S=6.5J·mol-1.;求出灰锡器皿不损坏的温度是 ℃((填“ >”、“ < ”或“=”)
Sn(s,白) ΔH=+2.1 kJ/mol,△S=6.5J·mol-1.;求出灰锡器皿不损坏的温度是 ℃((填“ >”、“ < ”或“=”) 2C(g)
2C(g) 
 2NH3达平衡,测得混合气体中N2、H2、NH3的量分别为m、n、gmol,如温度不变,只改变初始物质的加入量,而要求m、n、g总保持不变。若N2、H2、NH3的起始加入量用x、y、z表示时,应满足条件:
2NH3达平衡,测得混合气体中N2、H2、NH3的量分别为m、n、gmol,如温度不变,只改变初始物质的加入量,而要求m、n、g总保持不变。若N2、H2、NH3的起始加入量用x、y、z表示时,应满足条件: