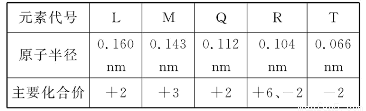题目内容
甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动。实验方案如下:
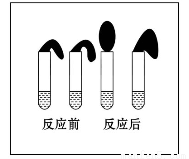
甲:取纯度相同,质量、大小相等的锌粒于两支试管中,同时加入 0.1 mol·L-1的HA溶液、稀盐酸各10 mL,按图装好,观察现象。
乙:① 用pH计测定浓度均为0.1 mol·L-1 的HA溶液和稀盐酸的pH;
② 再取0.1 mol·L-1的HA溶液和稀盐酸各2滴(1滴约为1/20 mL)分别稀释至100 mL,再用pH计测其pH变化。
(1)乙的方案中说明HA是弱电解质的理由是:测得0.1 mol·L-1的HA溶液的
pH 1(填“>”、“<”或“=”);甲方案中,说明HA是弱电解质的实验现象是:
(填序号)
A.加入两种稀酸后,两个试管上方的气球同时鼓起,且一样大
B.加入HA溶液后,试管上方的气球鼓起慢
C.加入稀盐酸后,试管上方的气球鼓起慢
(2) 乙同学设计的实验第 步,能证明改变条件弱电解质平衡发生移动。甲同学为了进一步证明弱电解质电离平衡移动的情况,设计如下实验:
①使HA的电离程度和c(H+)都减小,c(A-)增大,可在0.1 mol·L-1的HA溶液中,选择加入 试剂(选填“A”、“B”、“C”或“D”,下同);
②使HA的电离程度减小,c(H+)和c(A-)都增大,可在0.1 mol·L-1的HA溶液中,选择加入 试剂。
A.NaA固体(可完全溶于水)
B.1 mol·L-1 NaOH溶液
C.1 mol·L-1 H2SO4
D.2 mol·L-1 HA
(1)> B (2)② ①A ②D
【解析】(1)弱酸不能完全电离,故0.1 mol·L-1的HA中c(H+)必小于
0.1 mol·L-1,故pH>1,因HA为弱酸,溶液中的c(H+)低于相同浓度的一元强酸的c(H+),故产生氢气的速率稍慢,但最终由于电离出的氢离子的量相同,故生成氢气的体积一样大,即气球的体积一样大。
(2)乙方案中②,取0.1 mol·L-1的HA溶液和稀盐酸各2滴稀释相同的倍数,弱酸HA的pH变化小,强酸的pH变化大,这是因为稀释能促进弱电解质电离平衡的移动。