题目内容
【题目】25℃时,在25 mL 0.1mol/L的NaOH溶液中,逐滴加入0.2 mol/L的CH3COOH溶液,液pH与CH3COOH溶液体积关系如下图所示,下列有关粒子浓度大小关系正确的是
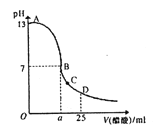
A. a=12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
B. C点时溶液中有: c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C. D点时溶液中有: c(CH3COO-) + c(CH3COOH)=2c (Na+)
D. 曲线上A、B间的任意一点,溶液中都有: c(Na+)>c(CH3COO-) >c(H+) >c(OH-)
【答案】C
【解析】A、反应至溶液显中性时,即c(OH-)=c(H+),醋酸应稍过量,a>12.5,且有c(Na+)=c(CH3COO-)>c(OH-)=c(H+),选项A错误;B、在C点,溶液显酸性,醋酸过量,溶液中有c(OH-)<c(H+),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故c(Na+)<c(CH3COO-),溶液中离子浓度大小关系为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),选项B错误;C、在D点时,醋酸剩余,剩余的醋酸的浓度和生成的醋酸钠浓度相等均为0.05mol/L,根据物料守恒可得:c(CH3COO-)+c(CH3COOH)=0.1mol/L,而c(Na+)=0.05mol/L,所以c(CH3COO-)+c(CH3COOH)=2 c(Na+),选项C正确;D、根据电荷守恒则有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),若c(Na+)>c(CH3COO-) >c(H+) >c(OH-)成立则与溶液必须呈电中性不相符合,选项D错误。答案选C。

【题目】已知X、Y、Z三种短周期元素在周期表中的位置如图所示,设X的原子序数为a。则下列说法正确的是
Y | ||
X | ||
Z |
A.Y是非金属性最强的元素
B.Z是金属元素
C.Y的原子序数为a-7
D.X的气态氢化物化学式为H2X

