题目内容
【题目】A、B、C、D是原子序数依次增大的短周期主族元素,A、C在元素周期表中的相对位置如图,A元素最外层与次外层的电子数之差为3,B为地壳中含量最多的金属元素。

(1)D原子结构示意图为_________。
(2)将C的低价态氧化物中通入到D单质的水溶液会使之褪色,体现了甲的_____性, 写出该反应的离子方程式________________。
(3)A的最高价氧化物对应的水化物是乙,现将过量Cu加入到100mL8.0mol/L乙的浓溶液中,充分反应,共收集到6.72L (标准状况)气体,则该气体的成分是________,还原剂失电子数为_________。
(4)将两份足量的B单质分别加入到等体积等浓度的盐酸和NaOH溶液中,充分反应生成气体的体积比为_______,若将反应后所得的溶液混合,会生成白色沉淀,发生反应的离子方程式为_________;B单质表面的氧化膜可用NaOH溶液除去,写出该反应的化学方程式_________。
【答案】 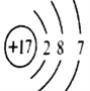 还原 Cl2+SO2+2H2O=4H++2Cl-+SO42- NO、NO2 0.5NA 1:3 Al3++3[Al(OH)4]-=4Al(OH)3↓ Al2O3+2NaOH+3H2O=2Na[Al(OH)4]
还原 Cl2+SO2+2H2O=4H++2Cl-+SO42- NO、NO2 0.5NA 1:3 Al3++3[Al(OH)4]-=4Al(OH)3↓ Al2O3+2NaOH+3H2O=2Na[Al(OH)4]
【解析】试题分析:根据A和C元素在周期表中的相对位置可知,A是第二周期元素。A元素最外层与次外层上的电子数之差为3,所以A的原子序数=2+5=7,即A是氮元素,则C是硫元素。B为地壳中含最最多的金属元素,所以B是铝元素。又因为A、B、C、D是原子序数依次增大的短周期主族元素,所以D是氯元素。
解析:(1)氯元素的原子序数是17位于第三周期第ⅦA族,其原子结构示意图为 。
。
(2)S的低价态氧化物甲是SO2,具有还原性,氯气具有强氧化性,因此SO2能使氯水褪色,二者发生的是氧化还原反应,反应的离子方程式为Cl2+SO2+2H2O=4H++2Cl-+SO42-。
(3)N的最高价氧化物对应的水化物乙是硝酸,属于氧化性酸,其浓溶液与铜反应的方程式为Cu+4HNO3=Cu(NO3)2+2H2O+2NO2↑。100 mL 8.0 mol/L乙的浓溶液中硝酸的物质的量=0.1L×8.0mol/L=0.8mol,如果全部被还原则生成NO2的物质的量是0.4mol,其标准状况下的体积=0.4mol×22.4L/mol=8.96L>6.72L,这说明生成的气体中还含有NO,这是由于随着反应的进行,硝酸的浓度逐渐减小,而稀硝酸的还原产物是NO。混合气的物质的量=6.72L÷22.4L/mol=0.3mol,则根据氮原子守恒可知,生成的硝酸铜的物质的量=(0.8mol-0.3mol)÷2=0.25mol。因此被氧化的铜单质的物质的量=0.25mol,所以还原剂失去电子的个数=0.25×2NA=0.5NA。
(4)铝与盐酸和氢氧化钠溶液反应的化学方程式分别是2Al+6HCl=2AlCl3+3H2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑。因此盐酸和氢氧化钠溶液的体积与浓度都相同的条件下与足量铝反应生成氢气的体积之比是1:3;氯化铝与偏铝酸钠反应生成氢氧化铝白色沉淀,反应的离子方程式为Al3++3[Al(OH)4]-=4Al(OH)3↓。氧化铝是两性氧化物,能溶解在氢氧化钠溶液中,反应的化学方程式为Al2O3+2NaOH+3H2O=2Na[Al(OH)4]。

 发散思维新课堂系列答案
发散思维新课堂系列答案