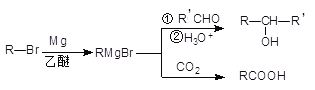
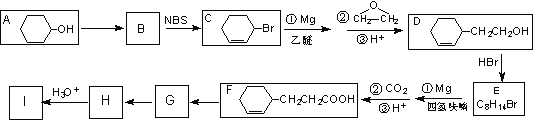
��Ŀ����
����Ŀ��������������ҡ������ˮ�����DZ����ˮ��Դ�������̲��ŷḻ�Ļ�ѧ��Դ��
��1����ҵ�Ͻ��к�ˮ�����ж��ַ�����
����������ʷ��ã��������ձȽϳ���ĺ�ˮ������������ͼ�Ǻ�ˮ����װ��ʾ��ͼ������B��������_________��

����ͼ��Ĥ���뼼�����к�ˮ������ԭ��ʾ��ͼ��ˮ���ӿ���������Ĥ������ˮ�������������Ӳ���ͨ������Ĥ����ѹ���Ҳຣˮ�м��ٵ���_______������ţ���

a. �������� b. ��Һ���� c. �ܼ����� d. ���ʵ����ʵ���Ũ��
��2�����ں�ˮ����Ҫ��I������ʽ���ڣ����ڵؿ�����Ҫ��IO3������ʽ���ڣ���������֮���ת����ϵ����ͼ����

�ٺ�ˮΪԭ�ϰ�����i��ȡI2�����ӷ���ʽ��___________________����֪I2������Cl2������Ӧ����IO3-���ɸ÷���ȡI2ʱӦע����Ƶķ�Ӧ������_______��
���Է���ii����Һ����ȡI2����Ӧ�����ӷ���ʽ�ǣ���֪����Ӧ��������Һ�����ԣ�________��
����ͼiii�з�Ӧ����Һ��IO3����Cl���ĸ�����Ϊ1��6����÷�Ӧ���������ͻ�ԭ�������ʵ���֮����__________��
���𰸡� ������ bc Cl2+2I-=2Cl-+I2 �������ܹ��� 2IO3-+5HSO3-=5SO42-+H2O+3H++ I2 3:1
��������
(1)����ȴˮ�Ľ���������������Ч����,������������������;������Ĥ��������ˮ����ͨ�����������Ӳ���ͨ��,���Ժ�ˮ���ܼ��������١����ʵ�������;(2)����������ǿ������,�ܽ�����������Ϊ��,��������ԭΪ������,�������˻������ⵥ��Ϊ���������;������������, IO3-��HSO3-����������ԭ��Ӧ����SO42-��H+��I2������������ClԪ�ػ��ϼ���0�۱�Ϊ-1�ۡ���ԭ����I-Ԫ�ػ��ϼ���-1�۱�Ϊ+5��,����ת�Ƶ��������ƽ����ʽ,�Ӷ�ȷ���������ͻ�ԭ�������ʵ���֮����
(1)��B��ȴװ�ã�ˮ�Ľ����������µ��ϡ���ͼ֪��������������������������ȷ����:��������
������Ĥ��������ˮ����ͨ�����������Ӳ���ͨ��,���Ժ�ˮ���ܼ��������١����ʵ�������,��ˮ��������,��ѡbc��������ȷ����:bc��
(2)����������ǿ������,�ܽ�����������Ϊ��,��������ԭΪ������,���ӷ���ʽΪCl2+2I-=2Cl-+I2,����ͼ����֪��,�÷���ȡI2ʱӦע����Ƶķ�Ӧ�������������ܹ�����������ȷ����Cl2+2I-=2Cl-+I2��Cl2������(������)��
������������,IO3-��HSO3-����������ԭ��Ӧ����SO42-��H+��I2,���ӷ�Ӧ����ʽΪ2IO3-+5HSO3-=5SO42-+H2O+3H++ I2,������ȷ����: 2IO3-+5HSO3-=5SO42-+H2O+3H++ I2��
����ͼiii��I�����IO3��ת��6e-���ڻ�ԭ����Cl2��ΪCl-ת��2e-����Ӧ����Һ��IO3����Cl-�ĸ�����Ϊ1��6��3Cl2+I-+3H2O=6Cl-+ IO3-+6 H+����Ӧ���������ͻ�ԭ�������ʵ���֮����3:1����ˣ�������ȷ����: 3:1��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�