题目内容
【题目】某研究小组将V1mL 1.0mol/LHCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL)。回答下列问题:
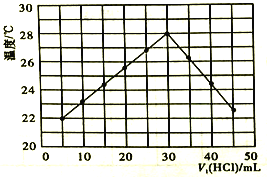
(1)研究小组做该实验时环境温度______(填“高于”、“低于”或“等于”)22℃,该反应是______热反应。
(2)由题干及图形可知,![]() _____时,酸碱恰好完全中和,此反应所用Na0H溶液的浓度应为______mol/L。
_____时,酸碱恰好完全中和,此反应所用Na0H溶液的浓度应为______mol/L。
【答案】 低于 放 3:2 1.5
【解析】根据图像的起始点分析温度,依据恰好反应时放热最多分析计算。
(1)根据实验结果图所示,5mLHCl溶液和45mLNaOH溶液反应放热后的温度已经是22℃,又HCl溶液和NaOH溶液反应是中和反应,为放热反应,可以知道该实验开始时温度一定是低于22℃;(2)恰好反应时参加反应的盐酸溶液的体积是30mL,由V1+V2=50mL,消耗的氢氧化钠溶液的体积为20mL,所以V1/V2=3/2;设恰好反应时氢氧化钠溶液中溶质的物质的量为n,则
HCl+NaOH=NaCl+H2O
1 1
1.0molL-1×0.03L n
则n=1.0molL-1×0.03L=0.03mol,所以浓度c=0.03mol÷0.02L=1.5mol/L。

练习册系列答案
 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目