题目内容
【题目】现有室温下四种溶液,有关叙述不正确的是
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH:①>②>④>③
D. ①与③溶液中,水的电离程度:①>③
【答案】D
【解析】A、③中CH3COOH![]() CH3COO-+H+,加入醋酸钠,抑制醋酸的电离,c(H+)减小,pH增大,④中发生HCl+CH3COONa=CH3COOH+NaCl,HCl属于强电解质,醋酸属于弱酸,因此溶液中c(H+)减小,pH增大,故A说法正确;B、因为醋酸是弱酸,因此c(CH3COOH)>c(NaOH),等体积混合后CH3COOH有剩余,溶液显酸性,即c(H+)>c(OH-),故B说法正确;C、NH3·H2O、NaOH属于碱,NaOH属于强碱,NH3·H2O属于弱碱,稀释相同倍数,NH3·H2O的pH变化小,NaOH的pH变化大,因此①>②,同理④>③,即pH的大小顺序①>②>④>③,故C说法正确;D、醋酸和NH3·H2O抑制水的电离,①中c(OH-)=10-3mol·L-1,③中c(H+)=10-3mol·L-1, ①③对水的抑制能力相同,故D说法错误。
CH3COO-+H+,加入醋酸钠,抑制醋酸的电离,c(H+)减小,pH增大,④中发生HCl+CH3COONa=CH3COOH+NaCl,HCl属于强电解质,醋酸属于弱酸,因此溶液中c(H+)减小,pH增大,故A说法正确;B、因为醋酸是弱酸,因此c(CH3COOH)>c(NaOH),等体积混合后CH3COOH有剩余,溶液显酸性,即c(H+)>c(OH-),故B说法正确;C、NH3·H2O、NaOH属于碱,NaOH属于强碱,NH3·H2O属于弱碱,稀释相同倍数,NH3·H2O的pH变化小,NaOH的pH变化大,因此①>②,同理④>③,即pH的大小顺序①>②>④>③,故C说法正确;D、醋酸和NH3·H2O抑制水的电离,①中c(OH-)=10-3mol·L-1,③中c(H+)=10-3mol·L-1, ①③对水的抑制能力相同,故D说法错误。

【题目】

请回答下列问题:
(1)实验室只有100 mL、250 mL、500 mL三种规格的容量瓶,但要配制480 mL 0.50 mol/L的稀硫酸,需取该浓硫酸 mL。
(2)接下来完成此实验你将用到的仪器有20 mL量筒、烧杯、玻璃棒、____________。
(3)要从所配溶液中取出50 mL盛装于试剂瓶中,给它贴上标签,则标签的内容是________________;若再从中取出10 mL溶液稀释至20 mL,则稀释后溶液的物质的量浓度为__________。
(4)下列操作会使所配溶液浓度偏低的是 。
A.用量筒量取浓硫酸,读数时仰视刻度线 |
B.转移溶液时未洗涤烧杯 |
C.容量瓶用蒸馏水洗净后仍残留有蒸馏水 |
D.定容时俯视容量瓶的刻度线 |
E.定容摇匀后,发现液面低于刻度线,再加水至刻度线
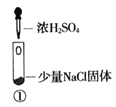
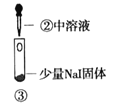
【题目】某小组比较Cl-、Br-、I-的还原性,实验如下:
实验1 | 实验2 | 实验3 | |
装置 |
|
|
|
现象 | 试管内颜色无明显变化;用蘸浓氨水的玻璃棒靠近管口,产生白烟 | 溶液变黄;把湿润的KI淀粉试纸靠近试管口,变蓝 | 溶液变深紫色;经检验溶液含单质碘 |
下列对实验的分析不合理的是
A. 实验1中,白烟是NH4Cl
B. 根据实验1和实验2判断还原性:Br->Cl-
C. 根据实验3判断还原性:I->Br-
D. .上述实验利用了浓H2SO4的强氧化性、难挥发性等性质