题目内容
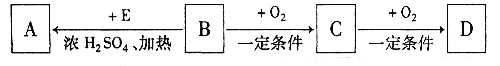
【题目】在一定条件下,向![]() 和过量C粉的混合物中通入氯气,可制得易水解的
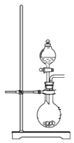
和过量C粉的混合物中通入氯气,可制得易水解的![]() ,实验装置如图所示。下列说法不正确的是
,实验装置如图所示。下列说法不正确的是 ![]()
![]()
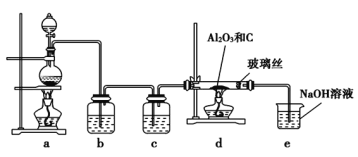
A.c中盛装的是浓硫酸
B.实验结束时,应先熄灭d处酒精灯,待装置冷却后再熄灭a处酒精灯
C.此反应中的尾气除氯气外都可直接排放到大气中
D.该装置不完善,其中应改进的一项是在d、e之间添加一个干燥装置
【答案】C
【解析】
A.b装置是除去氯气中的HCl,装的是饱和食盐水,c装置的作用是干燥A装置产生的氯气,装的应是浓硫酸,故A正确;
B.实验时应先点燃d处酒精灯,再点燃a处酒精灯,减小氯气造成的污染,故B正确;
C.分析发生的反应,尾气中还含有CO气体,CO也不能直接排放到大气中,故C错误;
D.将d和e直接相连,水蒸气可能会通过导管进入d装置使氯化铝水解,因此应在d、e之间添加一个干燥装置,故D正确。
故选:C。

练习册系列答案
相关题目
【题目】用如图装置制取并收集气体,对应的装置和试剂均正确的是( )
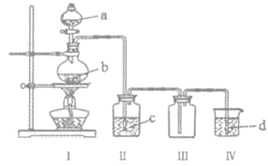
Ⅲ收集气体 | Ⅰ中试剂a,b | Ⅱ中试剂c | Ⅳ中试剂d | |
A | SO2 | 稀硫酸与铜片 | 浓硫酸 | NaOH溶液 |
B | Cl2 | 浓盐酸与二氧化锰 | 饱和氯化钠溶液 | NaOH 溶液 |
C | HBr | 浓硫酸与溴化钠 | 浓硫酸 | 水 |
D | CO | 甲酸与浓硫酸 | 浓硫酸 | 酸性KMnO4溶液 |
A. AB. BC. CD. D