题目内容
【题目】某工厂废水中含1.00×10﹣2mol/L的Cr2O72﹣ , 其毒性较大.某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4 , 设计了如图实验,下列说明正确的是( ) 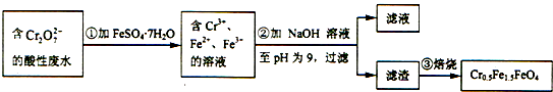
A.根据第①步反应可知还原性:Cr3+大于Fe2+
B.第②步过滤得到的滤渣中主要成分为Cr(OH)3、Fe(OH)2 , 不含Fe(OH)3
C.欲使1L该废水中的Cr2O72﹣完全转化为Cr0.5Fe1.5FeO4 , 理论上需要加入27.8g FeSO47H2O
D.第③步高温焙烧过程用到的主要实验仪器中属于硅酸盐质的有:酒精灯、蒸发皿、泥三角
【答案】C
【解析】解:Cr2O72﹣有较强氧化性,FeSO47H2O中Fe2+有一定的还原性,在酸性介质中发生氧化还原反应,由实验流程可知,第①步反应中Cr2O72﹣在酸性条件下将Fe2+氧化为Fe3+ , 自身被还原为Cr3+ , 加入NaOH溶液调节溶液pH为9,得到Cr(OH)3、Fe(OH)2、Fe(OH)3 , 过滤的滤渣经焙烧得到Cr0.5Fe1.5FeO4 ,
A.第①步反应中Cr2O72﹣在酸性条件下将Fe2+氧化为Fe3+ , 自身被还原为Cr3+ , 反应离子方程式为Cr2O72﹣+14H++6Fe2+=2Cr3++6Fe3++7H2O,还原性Cr3+小于Fe2+ , 故A错误;
B.由题给框图可知,Fe2+过量,加NaOH时,产生Cr(OH)3、Fe(OH)3和Fe(OH)2三种沉淀物,故B错误;
C.1 L废水中含n(Cr2O72﹣)=1.00×10﹣2 mol.根据Cr原子、Fe原子守恒,可得:
Cr2O72﹣~~~4Cr0.5Fe1.5FeO4~~~10FeSO47H2O,
所以理论上n(FeSO47H2O)=10n(Cr2O72﹣)=1.00×10﹣2 mol×10=0.1 mol,
所以m(FeSO47H2O)=0.1 mol×278 g/mol=27.8 g,故C正确;
D.加入固体,应在坩埚中进行,不能用蒸发皿,故D错误.
故选C.

 期末集结号系列答案
期末集结号系列答案


