题目内容
【题目】十九大报告提出了“积极参与全球环境治理,落实减排承诺”。其中氮的化合物的处理和利用是环境科学研究的热点。
(1)氮氧化物与悬浮大气中的海盐粒子相互作用会生成NOCl,涉及的相关反应有:
热化学方程式 | 平衡常数 | |
|
|
|
|
|
|
|
|
|
![]() 、
、![]() 、
、![]() 之间的关系为
之间的关系为![]() ______;
______;![]() 、
、![]() 、
、![]() 的关系为
的关系为![]() ______。
______。
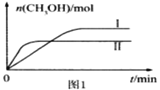
(2)对汽车加装尾气净化装置,可使汽车尾气中含有的CO、![]() 等有毒气体转化为无毒气体:
等有毒气体转化为无毒气体:![]() 对于该反应,温度不同
对于该反应,温度不同![]() ,其他条件相同时,下列图象正确的是______
,其他条件相同时,下列图象正确的是______![]() 填序号
填序号![]() 。
。

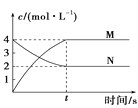
(3)用活性炭还原法也可以处理氮氧化物。向某密闭容器中加入一定量的活性炭和NO,发生反应:![]() 在
在![]() 时,反应进行到不同时间测得各物质的浓度如下:
时,反应进行到不同时间测得各物质的浓度如下:
时间 浓度 | 0 | 10 | 20 | 30 | 40 | 50 |
NO |
|
|
|
|
|
|
| 0 |
|
|
|
|
|
| 0 |
|
|
|
|
|
![]() 时,该反应在
时,该反应在![]() 的平均反应速率
的平均反应速率![]() ______;该反应的平衡常数
______;该反应的平衡常数![]() ______;
______;
![]() 后只改变某一条件,根据上表数据判断改变的条件可能是______
后只改变某一条件,根据上表数据判断改变的条件可能是______![]() 填序号
填序号![]() ;
;
A.加入一定量的活性炭 ![]() 恒温恒压充入氩气
恒温恒压充入氩气
C.适当缩小容器的体积 ![]() 加入合适的催化剂
加入合适的催化剂
【答案】2ΔH1-ΔH2 ![]() 乙
乙 ![]()
![]() (9/16) C
(9/16) C
【解析】
(1)本题考查盖斯定律和化学平衡常数的表达式,根据③的反应,因此有①×2-②得出△H3;①K1=![]() ,②K2=
,②K2=![]() ,③K3=
,③K3=![]() ,因此有K3=
,因此有K3=![]() ;
;
(2)本题考查影响化学反应速率的因素和勒夏特列原理,甲:升高温度,化学反应速率加快,即升高温度,正逆反应速率都增大;乙:T2>T1,T2先达到平衡,正反应是放热反应,升高温度,平衡向逆反应方向移动,则NO2的转化率降低;丙:升高温度,平衡向逆反应方向移动,CO的体积分数增大;
(3)本题考查化学反应速率的计算、化学平衡常数的计算、勒夏特列原理,①根据化学反应速率的数学表达式求算,根据化学平衡常数的表达式K=![]() 求算;
求算;
②A、加入活性炭,活性炭为固体,对化学平衡移动无影响;
B、恒温恒压下,充入氩气,容器的体积增大,组分的浓度降低;
C、适当缩小容器的体积,组分的浓度增大;
D、加入合适的催化剂,催化剂对化学平衡移动无影响。
(1)根据盖斯定律和化学平衡常数的表达式可知,根据③的反应,因此有①×2-②得出△H3=2△H1-△H2,①K1=![]() ,②K2=
,②K2=![]() ,③K3=
,③K3=![]() ,因此有K3=
,因此有K3=![]() ;
;
(2)甲:升高温度,化学反应速率加快,即升高温度,正逆反应速率都增大,故甲错误;
乙:T2>T1,T2先达到平衡,正反应是放热反应,升高温度,平衡向逆反应方向移动,则NO2的转化率降低,故乙正确;
丙:升高温度,平衡向逆反应方向移动,CO的体积分数增大,故丙错误;
答案选乙;
(3)①根据化学反应速率的数学表达式,v(CO2)=![]() mol/(L·min)=0.015mol/(L·min),根据表格数据,在20min达到平衡,根据化学平衡常数的表达式K=
mol/(L·min)=0.015mol/(L·min),根据表格数据,在20min达到平衡,根据化学平衡常数的表达式K=![]() =
=![]() =
=![]() ;
;
②A、加入活性炭,活性炭为固体,对化学平衡移动无影响,故A错误;
B、恒温恒压下,充入氩气,容器的体积增大,组分的浓度降低,故B错误;
C、适当缩小容器的体积,组分的浓度增大,故C正确;
D、加入合适的催化剂,催化剂对化学平衡移动无影响,故D错误;
答案选C。

 阅读快车系列答案
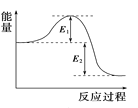
阅读快车系列答案【题目】某化学反应的能量变化如下图所示。下列有关叙述正确的是
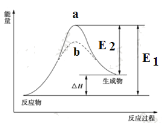
A. 该反应的焓变ΔH=E2-E1
B. a、b分别对应有催化剂和无催化剂的能量变化
C. 催化剂能改变反应的焓变
D. 催化剂能降低反应的活化能
【题目】已知反应A(g)+B(g) ![]() C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
温度/℃ | 700 | 830 | 1200 |
K值 | 1.7 | 1.0 | 0.4 |
A. 达到平衡后,B的转化率为50%
B. 增大压强,正、逆反应速率均加快
C. 该反应为吸热反应,升高温度,平衡正向移动
D. 反应初始至平衡,A的平均反应速率v(A)=0.005 mol·L-1·s-1