题目内容
1. 氯化铬酰(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应.请回答下列问题:
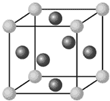
氯化铬酰(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应.请回答下列问题:(1)与铬同周期的所有元素的基态原子中,最外层电子数与铬原子相同的元素有K、Cu(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为:4.
(2)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶.据此可推断CrO2Cl2是非极性(填“极性”或“非极性”)分子.
(3)在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有①③(填符号),CS2分子的空间构型是直线形.
分析 (1)Cr原子最外层电子数为1,同周期元素有K、Cu;利用均摊法计算;
(2)根据相似相溶原理判断;
(3)当中心原子形成3个δ键(含孤对电子),应为sp2杂化,结合加成电子对互斥模型判断.
解答 解:(1)Cr原子最外层电子数为1,同周期元素有K、Cu,金属原子位于晶胞的顶点和面心,该晶胞中顶点含有的原子数为8×$\frac{1}{8}$=1个,面上含有的原子数为6×$\frac{1}{2}$=3个;所以含有4个原子,故答案为:K、Cu;4;
(2)根据相似相溶原理,非极性溶质易溶于非极性溶剂中,CCl4、CS2等是非极性溶剂,CrO2Cl2能与CCl4、CS2等互溶,所以CrO2Cl2是非极性分子,故答案为:非极性;
(3))①苯中碳原子采取sp2杂化;②CH3OH中碳原子采取sp3杂化;③HCHO中碳原子采取sp3杂化;④CS2中碳原子采取sp杂化;⑤CCl4中碳原子采取sp3杂化,CS2中碳原子采取sp杂化,且没有孤对电子,应为直线形分子,故答案为:①③;直线形.
点评 本题考查了晶胞的计算、相似相溶原理、原子轨道杂化方式及分子空间构型等知识点,属综合题,书写核外电子排布式时,注意把握相似相溶原理.

练习册系列答案
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
16.能正确表示下列反应的离子方程式为( )
| A. | 硫化亚铁溶于稀硝酸中:FeS+2 H+═Fe2++H2S↑ | |
| B. | NH4HCO3溶于过量NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| C. | 少量二氧化碳通入苯酚钠溶液中:C6H5O-+CO2+H2O═C6H5OH+CO32- | |
| D. | 大理石溶于醋酸中:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O |
6.以苯为原料,不能通过一步反应制得的有机物是( )
| A. | 氯苯 | B. | 硝基苯 | C. | 环己烷 | D. | 苯酚 |
13.常温下,0.01mol/L的盐酸与pH=12的NaOH溶液按体积比9:1混合,混合后溶液的pH为( )
| A. | 7 | B. | 2.1 | C. | 2.3 | D. | 11.9 |
10.关于硅及其化合物的叙述错误的是( )
| A. | SiO2是生产粗硅的主要原料 | |
| B. | 晶体硅(Si)是生产光缆和光导纤维的主要原料 | |
| C. | 水泥、玻璃、陶瓷的主要成份都是硅酸盐 | |
| D. | 盛放氢氧化钠溶液的玻璃试剂瓶不能用磨口玻璃塞 |
11.有机物香茅醇的结构简式为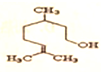 ,下列说法正确的是( )
,下列说法正确的是( )
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 化学式为C10H20O | B. | 遇FeCl3溶液发生显色反应 | ||
| C. | 属于芳香族化合物 | D. | 该有机物易溶于水 |
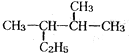
 的一氯取代物有5种
的一氯取代物有5种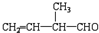 发生加聚反应所得产物的结构简式为
发生加聚反应所得产物的结构简式为 .
.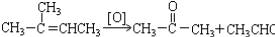
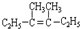 在上述类似条件下发生反应,请模仿上例写出该反应的方程式:
在上述类似条件下发生反应,请模仿上例写出该反应的方程式: .
.