题目内容
19世纪有些化学家测定某元素R的相对原子质量时,采用的方法是:用等容积的烧瓶4只,分别盛入N2,X、Y、Z四种气态物质,操作时先把烧瓶抽成真空,充气后使压强达到1.01×105 Pa,保证气体充满整个烧瓶,并称得每只烧瓶重,减去真空的瓶重而得到瓶内气体的质量(换算成标准状况),得到的数据如下表所示,将X、Y、Z气体中某元素R的质量分数也分别用实验测定,列入下表。
试回答:R的相对原子质量是多少?
| 气体 | 瓶中气体质量/g | R(%) | 气体 | 瓶中气体质量/g | R% |
| N2 | 0.652 | - | Y | 2.398 | 68.9 |
| X | 0.849 | 97.4 | Z | 3.583 | 92.2 |
| 气体 | 瓶中气体质量/g | R(%) | 气体 | 瓶中气体质量/g | R% |
| N2 | 0.652 | - | Y | 2.398 | 68.9 |
35.5
(1)n(N2)=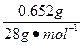 ="0.023" 3 mol,根据阿伏加德罗定律知同温、同压下同体积的各种气体,其物质的量相等,故计算如下:
="0.023" 3 mol,根据阿伏加德罗定律知同温、同压下同体积的各种气体,其物质的量相等,故计算如下:
气体 摩尔质量/g·mol-1
1 mol气体中R的质量/g
X 0.849/0.023 3=36.4
36.4×97.4%=35.5
Y 2.398/0.023 3=102.9
102.9×68.9%=70.9
Z 3.583/0.023 3=153.8
153.8×92.2%=141.8
因70.9≈35.5×2,141.8≈35.5×4,故上述数据中最小的是35.5,其余均为其倍数,又因1 mol化合物中至少含1 mol R原子,故元素R的相对原子质量为35.5。
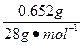 ="0.023" 3 mol,根据阿伏加德罗定律知同温、同压下同体积的各种气体,其物质的量相等,故计算如下:
="0.023" 3 mol,根据阿伏加德罗定律知同温、同压下同体积的各种气体,其物质的量相等,故计算如下:气体 摩尔质量/g·mol-1
1 mol气体中R的质量/g
X 0.849/0.023 3=36.4
36.4×97.4%=35.5
Y 2.398/0.023 3=102.9
102.9×68.9%=70.9
Z 3.583/0.023 3=153.8
153.8×92.2%=141.8
因70.9≈35.5×2,141.8≈35.5×4,故上述数据中最小的是35.5,其余均为其倍数,又因1 mol化合物中至少含1 mol R原子,故元素R的相对原子质量为35.5。

练习册系列答案
相关题目
 个氨分子含 摩氮原子, 摩氢原子, 摩质子, 个电子。
个氨分子含 摩氮原子, 摩氢原子, 摩质子, 个电子。


