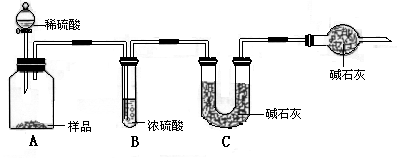
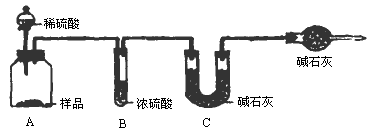
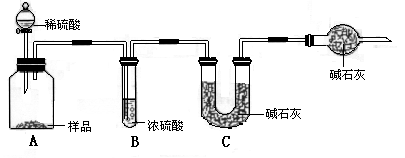
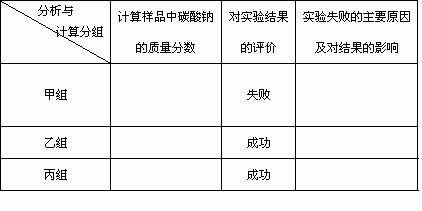
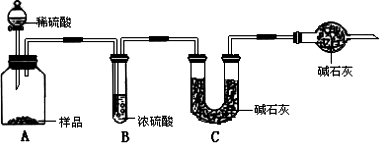
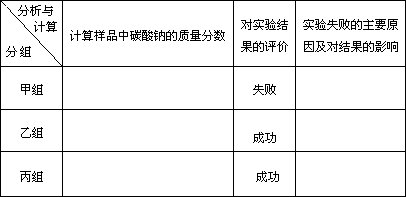
题目内容
| |||||||||||
解析:
(1) |
在饱和氯化钠溶液中通入氨气和二氧化碳,反应部分的水,从而有部分氯化钠晶体析出.(2分) |
(2) |
84.8%(2分)反应生成的CO2部分残留在瓶A中,没有被完全吸收,结果偏小(4分) 95.4%(2分) 99.6%(2分) |

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案下图是某工厂对海水资源进行综合利用的示意图.
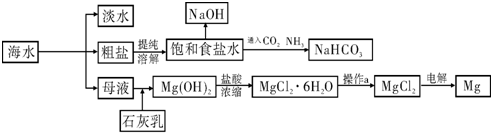
请回答下列问题:
(1)请列举一种海水淡化的方法
(2)工业上常用离子交换膜电解槽生产NaOH,电解过程中大量通过离子交换膜的离子是
(3)侯氏制碱法中首先向饱和食盐水中通入CO2和NH3制得NaHCO3,先通入
(填化学式),理由是
(4)镁是一种用途很广泛的金属材料,目前世界上60%的镁从海水中提取.已知有关物质的熔沸点数据如下:
| MgO | MgCl2 | |
| 熔点/℃ | 2852 | 714 |
| 沸点/℃ | 3600 | 1412 |
| |||||||||||