题目内容
【题目】火力发电厂释放出的大量NONOx、SO2、CO2会对环境造成污染.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现节能减排、废物利用等目的.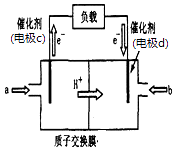
(1)脱硝:利用甲烷催化还原NOx;
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=﹣574kJmol﹣1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=﹣1160kJmol﹣1
甲烷直接将NO2还原为N2的热化学方程式为 .
(2)脱硫:①某种脱硫工艺将废气处理后可获得硫酸铵和硝酸铵,物质的量浓度相等的硫酸铵溶液和硝酸铵溶液,前者的c(NH4+)与后者的c(NH4+)的关系是 .
A.大于2倍 B.等于2倍 C.介于2倍与2倍之间 D.小于1倍
②25℃时pH均为4的硝酸铵溶液和稀硝酸中由水电离出的氢离子浓度分别为c1、c2 , 则c1与c2的比值等于 .
(3)脱碳:废气中的CO2转化为甲醇(CH3OH)可用于制作甲醇燃料电池(结构如图),质子交换膜左右两侧的溶液均为1L2molL﹣1H2SO4溶液.电极c上发生的电极反应式为 , 当电池中有1mole﹣发生转移时左右两侧溶液的质量之差为g (假设反应物a、b耗尽,忽略气体的溶解).
【答案】
(1)CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣867 kJ/mol
(2)A,106
(3)CH3OH+H2O﹣6e﹣=CO2↑+6H+,12
【解析】解:(1)已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=﹣574kJmol﹣1,
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=﹣1160kJmol﹣1,
不管化学反应是一步完成还是分几步完成,其反应热是相同的.利用盖斯定律将两式相加,可得
2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=﹣1734 kJ/mol,
即CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣867 kJmol﹣1,
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣867 kJ/mol;(2)①物质的量浓度相等的硫酸铵溶液和硝酸铵溶液,铵根离子水解溶液显酸性,铵根离子浓度越大其水解程度越小,前者的c(NH4+)与后者的c(NH4+)的关系是大于其2倍,故选A,
故答案为:A;
②硝酸铵水解促进水的电离,C1=10﹣4 mol/L,稀醋酸抑制水的电离,C2=c(OH﹣)= ![]() =10﹣10 mol/L,因此则c1与c2的比值等于
=10﹣10 mol/L,因此则c1与c2的比值等于 ![]() =106,
=106,
故答案为:106 ;(3)负极反应式为CH3OH﹣6e﹣+H2O=CO2+6H+,当转移1mol电子时,左侧质量减轻 ![]() ×12g=2g,还要有1molH+通过质子交换膜进入右侧,质量减少1g,正极反应式为O2+4H++4e﹣=2H2O,右侧质量增加32g×
×12g=2g,还要有1molH+通过质子交换膜进入右侧,质量减少1g,正极反应式为O2+4H++4e﹣=2H2O,右侧质量增加32g× ![]() =8g,加上转移过来的1gH+,因此左右两侧溶液的质量之差为8g+1g+2g+1g=12g,
=8g,加上转移过来的1gH+,因此左右两侧溶液的质量之差为8g+1g+2g+1g=12g,
故答案为:CH3OH+H2O﹣6e﹣=CO2↑+6H+;12.
(1)根据盖斯定律,利用已知化学反应方程式乘以某个系数相加或相减,构造出目标化学反应方程式,该化学反应的焓变即为已知化学反应方程式的焓变乘以某个系数相加或相减得到;(2)①物质的量浓度相等的硫酸铵溶液和硝酸铵溶液,铵根离子水解溶液显酸性,铵根离子浓度越大其水解程度越小;
②硝酸铵水解促进水的电离,C1=10﹣4 mol/L,稀醋酸抑制水的电离,C2=c(OH﹣)= ![]() =10﹣10 mol/L;(3)负极反应式为CH3OH﹣6e﹣+H2O=CO2+6H+,正极反应式为O2+4H++4e﹣=2H2O,按照电极反应式计算;
=10﹣10 mol/L;(3)负极反应式为CH3OH﹣6e﹣+H2O=CO2+6H+,正极反应式为O2+4H++4e﹣=2H2O,按照电极反应式计算;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案