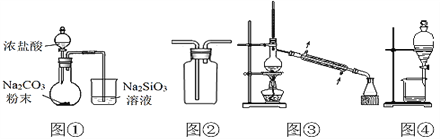
��Ŀ����
����Ŀ������Ԫ�����ڱ���һ���֣���Ա��еĢ١�����Ԫ�أ���д���пհף�
���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A |
2 | �� | �� | �� | �� | |||
3 | �� | �� | �� | �� |
��1��������������ˮ�����У�������ǿ�Ļ������������ �� ������ǿ�Ļ�����Ļ�ѧʽ�� ��
��2���ݢ��γɻ�����ĵ���ʽ �� ���γɵ����������Ľṹʽ ��
��3������������������������Ԫ����Ԫ�ط�������д����������������������������ˮ���ﷴӦ�����ӷ���ʽ ��
��4���ĵ�����ݵ�����������ˮ���ﷴӦ�����ӷ���ʽ�� ��
��5���ں͢߿��γ�ԭ����1��2��Һ̬������ף������ܽ�ߵĵ��ʣ��õ���ʽ��ʾ���γɹ��̣� ��
���𰸡�
��1�������NaOH
��2��![]() ��O=C=C
��O=C=C
��3��Al��Al��OH��3+3H+=Al3++3H2O
��4��2Al+2H2O+2OH��=2AlO2��+3H2��
��5��![]() +
+ ![]() +
+ ![]() ��
�� ![]()
���������⣺���ݸ�Ԫ�������ڱ��е����λ�ÿ�֪����ΪLi����ΪC����ΪN����ΪO����ΪNa����ΪAl����ΪS����ΪClԪ�أ���1��ͬ����������ҽ����Լ������ǽ�������ǿ����ͬ�������϶��½�������ǿ���ǽ����Լ�������ǽ�������ǿ��ΪCl����������ǿ�Ļ����������Ϊ�������������ǿ��ΪNa��������������ˮ���������ǿ����NaOH�����Դ��ǣ������ NaOH����2���ݢ��γɻ�����Ϊ���ƣ�����Ϊ���ӻ����������ֱ�������ӷ��ű�ʾ����������Ҫ���������ɼ��������ӣ�������ȷ�ĵ���ʽΪ ![]() �����γɵ����������ΪCO2 �� ������̼Ϊֱ���ͽṹ�������к�������̼��˫������ṹʽΪO=C=C�����Դ��ǣ�
�����γɵ����������ΪCO2 �� ������̼Ϊֱ���ͽṹ�������к�������̼��˫������ṹʽΪO=C=C�����Դ��ǣ� ![]() ��O=C=C����3��Al����������������ԣ�Al��NaOH��Ӧ����ƫ�����ƺ���������Ӧ�����ӷ�ӦΪ��2Al+2OH��+2H2O=2AlO2��+3H2�������Դ��ǣ�Al�� Al��OH��3+3H+=Al3++3H2O����4���ĵ���ΪAl���ݵ�����������ˮ����ΪNaOH��Al������������Һ��Ӧ����ƫ�����ƺ���������Ӧ�����ӷ���ʽΪ��2Al+2H2O+2OH��=2AlO2��+3H2�������Դ��ǣ�2Al+2H2O+2OH��=2AlO2��+3H2������5������̼����ԭ�Ӻ�̼ԭ��֮��ͨ�����ۼ��γɵĹ��ۻ�����õ���ʽ��ʾ���γɹ���Ϊ��
��O=C=C����3��Al����������������ԣ�Al��NaOH��Ӧ����ƫ�����ƺ���������Ӧ�����ӷ�ӦΪ��2Al+2OH��+2H2O=2AlO2��+3H2�������Դ��ǣ�Al�� Al��OH��3+3H+=Al3++3H2O����4���ĵ���ΪAl���ݵ�����������ˮ����ΪNaOH��Al������������Һ��Ӧ����ƫ�����ƺ���������Ӧ�����ӷ���ʽΪ��2Al+2H2O+2OH��=2AlO2��+3H2�������Դ��ǣ�2Al+2H2O+2OH��=2AlO2��+3H2������5������̼����ԭ�Ӻ�̼ԭ��֮��ͨ�����ۼ��γɵĹ��ۻ�����õ���ʽ��ʾ���γɹ���Ϊ�� ![]() +
+ ![]() +
+ ![]() ��
�� ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() +
+ ![]() +
+ ![]() ��
�� ![]() ��
��

 ������ÿ�ʱ��ҵϵ�д�
������ÿ�ʱ��ҵϵ�д�