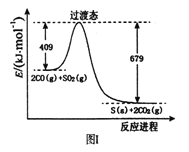
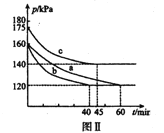
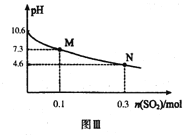
��Ŀ����
����Ŀ���������е�һ��ѧ2017����ѧ�ڵ�������Ӧ�Կ��ԡ�U��V��W��X��Y��Z��ԭ��������������Ķ�����Ԫ�ء���֪��
��WU4++XU-==WU3+U2X�����ַ�Ӧ���������ĵ�����������Y+��ȣ�
��Z�ĵ�����X2��ȼ�յIJ����ʹƷ����Һ��ɫ��
��V�ĵ�����X2��ȼ�տ�����VX��VX2�������壻
��Y�ĵ�����һ�ֽ������ý�����X2��Ӧ������Y2X��Y2X2���ֹ��塣
��ش��������⣺
��1��д��Y2X2��ˮ��Ӧ�Ļ�ѧ����ʽ��________________��
��2��V��W��X�γɵ�10�����⻯���У��е���ߵ���__________(д��ѧʽ)��
��3��U2X2��FeSO4�����ʵ���֮��1��2����ϡ�����У���Ӧ�����ӷ���ʽΪ__________��
��4�������£���pH=11��Y2VX3��Һ�м������ʯ���飬���˺�������ҺpH=13����Ӧǰ����Һ���뷴Ӧ�����Һ��ˮ�������c(OH-)�ı�ֵ��_________��
��5����֪��U��W����Ԫ����ɵĹ��ۻ��������������ģ����ͼ��ʾ�����������ӵĵ���ʽΪ_______������Ϊ��Ԫ�����ˮ�еĵ��뷽��ʽ�백���ƣ�������һ�����뷴Ӧ��ƽ�ⳣ��ֵΪ_______(��֪��N2H4+H+==N2H5+��K=8.7��107��KW=1.0��10-14)����������������γɵ���ʽ�εĻ�ѧʽΪ_______��

���𰸡� 2Na2O2+2H2O=4NaOH+O2�� H2O H2O2+2Fe2++2H+=2Fe3++2H2O 1��1010 ![]() 8.7��10-7 N2H6(HSO4)2
8.7��10-7 N2H6(HSO4)2
�����������⿼��Ԫ�ص��ƶϣ������ݻ�ѧ��Ӧ����ʽ���Ƴ��˷�ӦʽNH4����OH��=NH3��H2O��������10�����ӣ���YΪNa����Z�ĵ�����O2��ȼ�յIJ����ʹƷ����Һ��ɫ����������SO2����ZΪS����V�ĵ���������ȼ�տ�����VX��VX2����VΪC����1��Y2X2ΪNa2O2����ˮ��Ӧ�Ļ�ѧ����ʽΪ2Na2O��2H2O=4NaOH��O2������2���⻯��ֱ���CH4��NH3��H2O��H2O��NH3���ڷ��Ӽ������CH4��û�У����CH4�ķе���ͣ�NH3��H2O��H2O����Է����������H2O�ķе����NH3��H2O�ķе���ߣ���3����H2O2��FeSO4�ķ�Ӧ������H2O2��������Fe2��������Fe3���������ӷ�ӦʽΪH2O2��2Fe2����2H��=2H2O��2Fe3������4��Y2VX3�Ļ�ѧʽΪNa2CO3��pH=11��Na2CO3��Һ�У���ˮ����c(OH��)=Kw/c(H��)=10��14/10��11mol��L��1=10��3mol��L��1������ʯ�����õ���ҺΪNaOH����ʱ��Һ��ˮ����c(OH��)=c(H��)=10��13mol��L��1��������߱�ֵΪ10��3/10��13=103��1����5����ɵķ���ʽΪN2H4�������ʽΪ��![]() ������Ϊ��Ԫ�����ˮ�еĵ��뷽��ʽ�백���ƣ���������һ������ķ���ʽΪN2H4+H2O
������Ϊ��Ԫ�����ˮ�еĵ��뷽��ʽ�백���ƣ���������һ������ķ���ʽΪN2H4+H2O![]() N2H5����OH����ƽ�ⳣ��K1=c(N2H5��)��c(OH��)/c(N2H4)��K��Kw8.7��107��1��10��14��8.7��10��7������Ϊ��Ԫ��������кͷ�Ӧ�����Σ�����������������γ���ʽ�εĻ�ѧʽΪN2H6(HSO4)2 ��
N2H5����OH����ƽ�ⳣ��K1=c(N2H5��)��c(OH��)/c(N2H4)��K��Kw8.7��107��1��10��14��8.7��10��7������Ϊ��Ԫ��������кͷ�Ӧ�����Σ�����������������γ���ʽ�εĻ�ѧʽΪN2H6(HSO4)2 ��