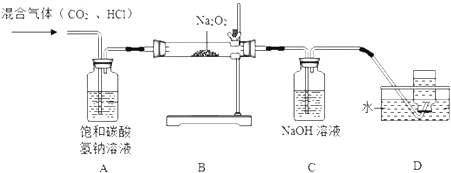
题目内容
【题目】铁元素存在多种硫化物,兴趣小组为测定某铁硫化物(FeaSy)的组成按下列流程进行探究:
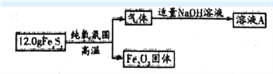
回答下列问题:
(1)测得Fe2O3固体的质量为8.0g,则FeaSy的化学式为______________。请设计实验检验Fe2O3中含有+3价铁:__________________________。
(2)铁硫化物在纯氧中发生反应的化学方程式为______________________________。
(3)兴趣小组同学推测溶液A中除含有Na2SO3外,还可能含有Na2SO4。设计实验方案并探究:
①用0.10 mol·L-1酸性KMnO4溶液应盛装在_______________(填“酸式“或“碱式”)滴定管中,然后进行滴定,反应的离子方程式为_________________________。
②确认A溶液中是否含有Na2SO4

请用化学方程式解释该方案不合理的原因____________________________________。
【答案】 FeS2 取少量固体Fe2O3于试管中,向试管中加入适量稀盐酸使固体溶解,滴加KSCN溶液,溶液变为血红色。或取少量Fe2O3固体于试管中,向试管中加入适量稀盐酸使固体溶解,滴加K4[Fe(CN)6]溶液,产生蓝色沉淀 4FeS2+11O2![]() Fe2O3+8SO2 酸式 2MnO4-+5SO32-+6H+=5SO42-+2Mn2++3H2O 3BaSO3+2HNO3=3BaSO4+2NO↑+H2O
Fe2O3+8SO2 酸式 2MnO4-+5SO32-+6H+=5SO42-+2Mn2++3H2O 3BaSO3+2HNO3=3BaSO4+2NO↑+H2O
【解析】本题考查Fe及其化合物。主要涉及的考点计算、离子方程式的书写、铁离子的检验。(1)8.0g Fe2O3 中为含Fe的质量为![]() =5.6g,故12.0 FeaSy中S的质量为12.0g-5.6g=6.4g,故n(Fe):n(S)=
=5.6g,故12.0 FeaSy中S的质量为12.0g-5.6g=6.4g,故n(Fe):n(S)= ![]() =1:2,故FeaSy的化学式为FeS2;检验+3价铁,需要用KSCN溶液或K4[Fe(CN)6]溶液,故其方法为:取少量固体Fe2O3于试管中,向试管中加入适量稀盐酸使固体溶解,滴加KSCN溶液,溶液变为血红色。或取少量Fe2O3固体于试管中,向试管中加入适量稀盐酸使固体溶解,滴加K4[Fe(CN)6]溶液,产生蓝色沉淀;(2)FeS2与氧气反应生成Fe2O3和8SO2,方程式为4FeS2+11O2
=1:2,故FeaSy的化学式为FeS2;检验+3价铁,需要用KSCN溶液或K4[Fe(CN)6]溶液,故其方法为:取少量固体Fe2O3于试管中,向试管中加入适量稀盐酸使固体溶解,滴加KSCN溶液,溶液变为血红色。或取少量Fe2O3固体于试管中,向试管中加入适量稀盐酸使固体溶解,滴加K4[Fe(CN)6]溶液,产生蓝色沉淀;(2)FeS2与氧气反应生成Fe2O3和8SO2,方程式为4FeS2+11O2![]()
![]() Fe2O3+8SO2;(3)①酸性KMnO4溶液具有强氧化性,故应装在酸式滴定管中,然后进行滴定,滴定时,MnO4-将SO32-氧化为SO42-,自身被还原为Mn2+,反应的离子方程式为:2MnO4-+5SO32-+6H+=5SO42-+2Mn2++3H2O;②确认A溶液中是否含有Na2SO4方案不合理,因稀硝酸具有强氧化性,能将SO32-氧化为SO42-,其反应方程式为:3BaSO3+2HNO3=3BaSO4+2NO↑+H2O。
Fe2O3+8SO2;(3)①酸性KMnO4溶液具有强氧化性,故应装在酸式滴定管中,然后进行滴定,滴定时,MnO4-将SO32-氧化为SO42-,自身被还原为Mn2+,反应的离子方程式为:2MnO4-+5SO32-+6H+=5SO42-+2Mn2++3H2O;②确认A溶液中是否含有Na2SO4方案不合理,因稀硝酸具有强氧化性,能将SO32-氧化为SO42-,其反应方程式为:3BaSO3+2HNO3=3BaSO4+2NO↑+H2O。

 阅读快车系列答案
阅读快车系列答案【题目】在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间(s) C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
C(N2O4) | 0. 20 | a | 0.10 | c | d | e |
C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅。
(1)该反应的化学方程式为__________________________,表中b_________c(填“<”、“=”、“>”)。
(2)20s时,N2O4的的浓度为__________________mol·L-1,0~20s内N2O4的平均反应速率为________________;
(3)该反应的平衡常数表达式K=___________________
在80℃时该反应的平衡常数K值为:______________(保留到小数点后2位)。
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时____________。
A.N2O4的转化率越高 B.NO2的产量越大
C.N2O4与NO2的浓度之比越大 D.正反应进行的程度越大
【题目】某强酸性无色溶液中可能含下表离子中的若干种离子。
阳离子 | Mg2+、NH4+、Ba2+、Al3+、Fe2+ |
阴离子 | SiO32-、MnO4-、Cl-、NO3-、SO32- |
实验I :取少量该试液进行如下实验。

实验Ⅱ:为了进一步确定该溶液的组成,取100 mL原溶液,向该溶液中滴加1 mol L-l的 NaOH溶液,产生沉淀的质量与氢氧化钠溶液体积的关系如图所示。

回答下列问题:
(1)不进行实验就可以推断出,上表中的离子一定不存在的有___________种。
(2)通过实验I可以确定该溶液中一定存在的阴离子是_____________。检验气体X的方法是______________________;沉淀Z的化学式为_________________。
(3)写出实验Ⅱ的图象中BC段对应的离子方程式:_____________________________________。
(4) A点对应的固体质量为__________g。
(5)通过上述信息,推算该溶液中阴离子的浓度为______________mol L-l。