题目内容
向一定量的Fe、FeO和Fe3O4的混合物中加入120 mL 4 mol·L一1的稀硝酸,恰好使混合物完全溶解,放出0.06 mol NO,往所得溶液中加入KSCN溶液,无血红色出现。若用足量的氢气在加热下还原相同质量的原混合物,能得到铁的物质的量为 ( )
| A.0.14 mol | B. 0.16 mol | C. 0.21 mol | D.0.24 mol |
C
试题分析:溶液中的反应,溶质为Fe(NO3)2,通过计算N元素的物质的量来求得Fe元素的物质的量,n(HNO3)=0.12L*4mol·L一1="0.48mol,n(NO)=0.06mol," n(Fe)=n[Fe(NO3)2]="(0.48mol-0.06mol)/2=0.21" mol。故选C。
点评:本题如果根据化学方程式进行计算非常的麻烦,用守恒法解答此题是非常的方便。守恒存在于整个自然界的千变万化之中。化学反应是原子之间的重新组合,反应前后组成物质的原子个数保持不变,即物质的质量始终保持不变,此即质量守恒。

练习册系列答案
相关题目
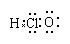
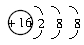
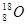
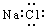
 (三个原子在同一直线上)
(三个原子在同一直线上)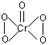 ,该氧化物中Cr为+6价
,该氧化物中Cr为+6价