题目内容
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途,某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(l)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化,再向试管中通入空气,溶液逐渐变红。由此可知:①样品中没有Fe3+、②_______。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按下图连接好装置进行实验。
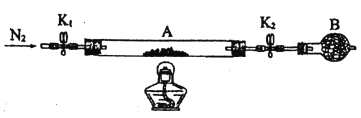
①将下列实验操作步骤正确排序_______(填标号):重复上述操作步骤,直至A恒重,记为m3g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却到室温
②根据实验记录,计算绿矾化学式中结晶水数目x=_______(列式表示)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

①C、D中的溶液依次为_______(填标号)。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.液H2SO4
②写出硫酸亚铁高温分解反应的化学方程式__________。
【答案】 Fe2+易被氧气氧化为Fe3+ dabfce ![]() c、a 2FeSO4
c、a 2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
【解析】(l)亚铁离子不稳定,易被空气中氧气氧化生成铁离子,Fe2+易被氧气氧化为Fe3+ ;(2)①
实验时,为避免亚铁被氧化,应先通入氮气,冷却时注意关闭开关,防止氧气进入,冷却至室温再称量固体质量的变化,则正确的顺序为dabcfe。②直至A恒重,记为m3 g,应为FeSO4和装置的质量,则m(FeSO4)=(m3-m1),m(H2O)=(m2-m3),则n(H2O)=(m2-m3)/18、n(FeSO4)=(m3-m1)/152,结晶水的数目等于n(H2O)/n(FeSO4)=76(m2- m3)/9(m3-m1);(3)①实验后反应管中残留固体为红色粉末,说明生成Fe2O3,则反应中Fe元素化合价升高,S元素化合价应降低,则一定生成SO2,可知硫酸亚铁高温分解可生成Fe2O3、SO3、SO2,C为氯化钡,用于检验SO3,可观察到产生白色沉淀,D为品红,可用于检验SO2,品红褪色,
故选:c、a;②硫酸亚铁高温分解可生成Fe2O3、SO3、SO2,反应的化学方程式 2FeSO4![]() Fe2O3+SO2↑+SO3↑。
Fe2O3+SO2↑+SO3↑。

【题目】表是元素周期表的一部分,其中每个数字序号代表一种短周期元素.
① | ||||||||
② | ③ | |||||||
④ | ⑤ | ⑥ | ||||||
请按要求回答下列问题:
(1)元素②在周期表中的位置为
(2)④、⑤两种元素相比较,金属性强的是(填元素符号);
(3)这些元素的最高价氧化物对应水化物中酸性最强的是(填化学式,下同),具有两性的是 .
(4)元素④和元素⑥形成的化合物的电子式为 .
(5)元素③和元素⑥的氢化物均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式 .
【题目】下列实验操作能达到实验目的或得出相应结论的是
实 验 操 作 | 目的或结论 | |
A | 将Cu片放入FeCl3溶液中 | 证明Fe的金属性比Cu强 |
B | 将点燃的镁条置于盛有CO2的集气瓶中,瓶内壁有黑色固体生成 | 镁与CO2发生置换反应 |
C | 将SO2通入溴水或酸性高锰酸钾溶液中 | 证明SO2有漂白性 |
D | 向FeCl2溶液(含少量FeBr2杂质)中,加入适量氯水,再加CCl4萃取分液 | 除去FeCl2溶液中的FeBr2 |
A. A B. B C. C D. D

