��Ŀ����
����Ŀ���ױ��������Ʊ�������ķ�Ӧԭ�����£� 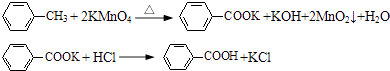
ʵ��ʱ��һ�����ļױ���KMnO4��Һ����ͼ1װ���У���100��ʱ����Ӧһ��ʱ�䣬��ֹͣ��Ӧ�������������̷����������ͻ���δ��Ӧ�ļױ���
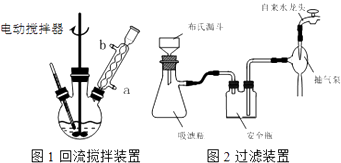
��1��ʵ������ʵ�ֲ���������IJ������������ձ��������������Ϊ ��
��2�������Һ����ɫ��Ҫ�ȼ���������أ�Ȼ���ټ���Ũ�����ữ�����˲�������ֵ�Σ���� ��
��3���ڲ������У�����ǰ�������ȴ��Һ����ԭ��������ͼ2��ʾ������ϣ�Ӧ�ȶϿ���Ƥ�ܣ�
��4�����Ȳⶨ����ȡ1.220g��Ʒ�����100mL��Һ��ȡ����25.00mL��Һ�����еζ�������KOH���ʵ���Ϊ2.4��10��3 mol����Ʒ�б�������������Ϊ ��
���𰸡�
��1����Һ©��������
��2�������ĸ�������������ᣬ��������
��3���õ��ϴ�ı����ᾧ�������ڳ��ˣ������úͰ�ȫƿ
��4��96%
���������⣺һ�����ļױ���������KMnO4��Һ��100�淴Ӧһ��ʱ���ֹͣ��Ӧ������ͼ���̷����������ͻ���δ��Ӧ�ļױ���������������ˮ���ױ�������ˮ���������ܵ�Һ����÷�Һ�������룬����ʵ��Ŀ��֪���Ӷ��õ��л����ˮ�㣬�л����к��мױ���ˮ���к��б����ᣬ�л����еļױ����������õ���ɫҺ��A��A�Ǽױ�����ˮ�������ữ������Ũ�������ݱ�������ܽ��֪���õ��Ĺ���B�DZ����ᣬ��1�����뻥�����ܵ�Һ����÷�Һ��������������ͼ�У�ˮ����л��㲻���ܣ����Կ��Բ��÷�Һ�������룬Ҫ�÷�Һ©�����л��������ʻ����ҷе㲻ͬ�����Կ��Բ����������룬 ���Դ��ǣ���Һ©��������2�������Һ����ɫ��˵��������ع�����Ҫ�ȼ���������أ���������ػ�ԭ������Ũ������ܱ�������������
���Դ��ǣ������ĸ�������������ᣬ������������3���ڲ������У�����ǰ�������ȴ��Һ�����Եõ��ϴ�ı����ᾧ�������ڳ��ˣ�������ϣ�Ӧ�ȶϿ������úͰ�ȫƿ֮�����Ƥ�ܣ�
���Դ��ǣ��õ��ϴ�ı����ᾧ�������ڳ��ˣ������úͰ�ȫƿ����4���豽��������ʵ���Ũ��Ϊx����25mL��������Һ�б���������ʵ���=0.025xmol��
C6H5COOH+KOH�� | C6H5COOK+H2O |
1mol | 1mol |
0.025xmol | 2.40��10��3mol |
1mol��1mol=0.025xmol��2.40��10��3mol
x= ![]() =0.96��
=0.96��
��100mL����������������=0.096mol/L��0.1L��122g/mol=1.1712g��
����������= ![]() =96%��
=96%��
���Դ��ǣ�96%��



