题目内容
【题目】某学生为了探究钠与CO2的反应,利用如图装置进行实验。[已知PdCl2(氯化钯)能被CO还原得到黑色的Pd]

(1)请将上图各装置连接完整(填写装置中序号)②→ 。
(2)若用稀盐酸与CaCO3反应制备CO2,在加稀盐酸时,发现CaCO3与稀盐酸不能接触,而稀盐酸又不够了,为使反应能顺利进行,可向装置②长颈漏斗中加入的试剂是 。
A.CCl4 | B.H2SO4溶液 | C.硝酸钠溶液 | D.植物油 |
(3)检查装置②的气密性,方法是 。
(4)装好药品后,点燃酒精灯之前应进行的操作是打开弹簧夹,让CO2充满整个装置,当观察到 时再点燃酒精灯。
(5)通入CO2的量不同可能会导致生成的产物不同。假如反应过程中有下列两种情况,按要求分别写出两种情况时的化学方程式 。
i.当装置⑤PdCl2溶液中观察到有黑色沉淀产生,装置①中固体成分只有一种,且向固体中加入稀盐酸产生能使澄清石灰水变浑浊的气体,写出此情况时钠与CO2反应的化学方程式 。
ii.当装置①中钠的质量为0.23 g时,充分反应后,将装置①中的固体加入到足量稀盐酸中,产生112 mL的CO2气体(标况下测定),装置⑤PdCl2溶液中没有观察到黑色沉淀产生,写出此情况时钠与CO2反应的化学方程式 。
【答案】(共12分)(1)④③①⑤(2分); (2)AC(2分);
(3)用弹簧夹夹住C处橡皮管,向装置②中长颈漏斗中加水,一段时间后水不能顺利流下,且长时间液面差稳定(2分);(4)装置⑤中左端试管中澄清石灰水变浑浊(2分);
(5)i 2Na+2CO2![]() Na2CO3+CO(2分);ii 4Na+3CO2
Na2CO3+CO(2分);ii 4Na+3CO2![]() 2Na2CO3+C(2分);
2Na2CO3+C(2分);
【解析】试题分析:(1)探究钠与CO2的反应,首先用盐酸和碳酸钙在②中反应制取二氧化碳气体,制取的二氧化碳中混有挥发出来的HCl,需要用装置④中的饱和碳酸氢钠溶液除去HCl,然后用③浓硫酸干燥,再在①中进行钠与二氧化碳的反应,最后用装置⑤检验反应产物,所以装置的连接顺序为②④③①⑤;
(2)A.CCl4:四氯化碳的密度大于稀盐酸,加入四氯化碳后会,四氯化碳层在混合液下层,从而使盐酸与碳酸钙接触,A正确;A.H2SO4溶液:加入H2SO4溶液后,虽然可以增大溶液体积,使溶液与碳酸钙接触,但生成的硫酸钙微溶,覆盖在碳酸钙表面阻止反应进一步进行,B错误;C.硝酸钠:加入稀硝酸钠后,可以增大溶液体积,使溶液与碳酸钙接触,C正确;D.植物油:植物油的密度小于盐酸,加入植物油后,植物油在混合液上层,无法使稀盐酸与碳酸钙接触,D错误; 答案选AC。
(3)根据装置②的构造可知检验气密性的方法是用弹簧夹夹住C处橡皮管,向装置②中长颈漏斗中加水,一段时间后水不能顺利流下,且长时间液面差稳定;
(4)钠化学性质比较活泼,能够与空气中的氧气、水反应,所以点燃酒精灯之前应需要打开弹簧夹,让CO2充满整个装置,以便排尽装置中的空气,避免空气中O2、H2O干扰实验;当装置装置⑤中澄清石灰水变浑浊时,证明装置中空气已经排净;
(5)Ⅰ.装置⑤PdCl2溶液中观察到有黑色沉淀,又PdCl2能被CO还原得到黑色的Pd,则黑色沉淀为Pd,则钠与二氧化碳反应生成了CO;装置①中固体成分只有一种,且向固体中加入稀盐酸产生能使澄清石灰水变浑浊的气体,该气体为二氧化碳,则钠与二氧化碳反应生成碳酸钠和CO,反应的方程式为2Na+2CO2![]() Na2CO3+CO;
Na2CO3+CO;
Ⅱ.装置①中钠的质量为0.23g,钠的物质的量为:n(Na)=0.23g÷23g/mol=0.01mol,将装置①中的固体加入到足量稀盐酸中产生112mL(标准状况)CO2气体,二氧化碳的物质的量为:n(CO2)=0.112L÷22.4L/mol=0.005mol,则反应后生成碳酸钠的物质的量为0.005mol,说明钠完全转化成了碳酸钠;溶液中还有固体残留,根据化合价变化可知,残留的固体只能为C,则钠与二氧化碳反应生成了碳酸钠和C,反应的化学方程式为:4Na+3CO2![]() 2Na2CO3+C。
2Na2CO3+C。

【题目】完成下列问题。
Ⅰ.已知甲和乙为中学常见金属单质,丙和丁为常见气体单质,A~E为常见化合物;A为淡黄色固体,常温下B为液体,C的焰色反应为黄色。试回答下列问题:
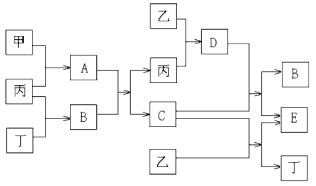
(1)A和E的化学式分别为____________、_____________;
(2)A+B → C+丙的化学方程式:____________________________;
(3)D+C → B+E的离子方程式:________________________________;
(4)1 mol甲和1 mol乙混合投入到足量的B中,在标准状况下,最多能产生________L丁气体。
Ⅱ.在标准状况下,取甲、乙、丙各30mL相同浓度的盐酸,然后分别慢慢加入组成相同的铝镁混合物,得下表中有关数据(反应前后溶液体积不发生变化)。
实验序号 | 甲 | 乙 | 丙 |
混合物质量/mg | 255 | 385 | 459 |
气体体积/mL | 280 | 336 | 336 |
(1)甲组实验中,盐酸__________(填“过量”、“适量”或“不足”);
乙组实验中,盐酸__________(填“过量”、“适量”或“不足”)。
(2)盐酸的物质的量的浓度为_____________mol/L。
(3)混合物中Mg和Al的物质的量之比为___________。
【题目】700℃时,H2(g)+CO2(g)![]() H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示。其中甲经2min达平衡时,v (H2O)为0.025 mol/(L·min),下列判断不正确的是( )
H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示。其中甲经2min达平衡时,v (H2O)为0.025 mol/(L·min),下列判断不正确的是( )
起始浓度 | 甲 | 乙 | 丙 |
C(H2)/mol/L | 0.1 | 0.2 | 0.2 |
C(CO2)/mol/L | 0.1 | 0.1 | 0.2 |
A.平衡时,乙中CO2的转化率大于50%
B.当反应平衡时,丙中c(CO2)是甲中的2倍
C.温度升至800℃,上述反应平衡常数为25/16,则正反应为吸热反应
D.其他条件不变,若起始时向容器乙中充入0.10mol/L H2和0.20 mol/L CO2,到达平衡时c (CO)与乙不同
