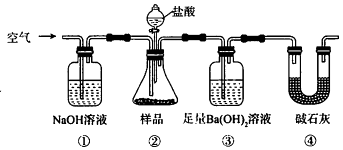
��Ŀ����
����Ŀ�������£�0.1mol/L�Ķ�Ԫ��H2A��Һ�У���Һ��ϵ���ܴ��ڵĺ�A���ӣ�H2A��HA����A2������ռ���ʵ���������pH�仯�Ĺ�ϵ��ͼ��ʾ������˵����ȷ���ǣ� ��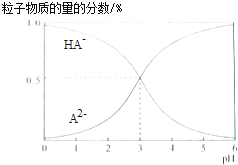
A.H2A�ĵ��뷽��ʽΪ��H2AH++HA��
B.pH=5ʱ����NaHA��Na2A�Ļ����Һ�У�c��HA������c��A2����=1��100
C.�����ʵ���Ũ�ȵ�NaHA��Na2A��Һ�������ϣ�����Ũ�ȴ�С��ϵΪc��Na+����c��HA������c��A2����
D.Na2A��Һ�ش���c��OH����=c��H+��+c��HA����+2c��H2A����������Ũ�Ⱦ�����0
���𰸡�B
��������A����Ԫ��H2A��Һ�в���������ӣ�˵����һ����ȫ���룬��Ԫ��H2A�ĵ��뷽��ʽΪ��H2A=H++HA�� �� HA��H++A2�� �� ��A����
B����ͼ�������pH=3ʱ��c��HA������c��A2������ͬ��pH=5ʱ��c��HA������c��A2����=1��100����B��ȷ��
C�������ʵ���Ũ�ȵ�NaHA��Na2A��Һ�������Ϻ����Ƚ�c��HA������c��A2�����Ĵ�С����C����
D����Ԫ��H2A�ĵ��뷽��ʽΪ��H2A=H++HA�� �� HA��H++A2�� �� Na2A��Һ�в�����H2A���ӣ�c��H2A��=0����D����
��ѡB.
A����Ԫ��H2A��Һ�в�����H2A���ӣ�˵����һ����ȫ���룬��Ԫ��H2A�ĵ��뷽��ʽΪ��H2A=H++HA�� HA��H++A2����
B����ͼ�������pH=3ʱ��c��HA������c��A2������ͬ��pH=5ʱ��c��HA������c��A2����=1��100��
C����֪��HA���ĵ���̶���A2����ˮ��̶��ĸ�����
D��Na2A��Һ�в�����H2A���ӣ�