题目内容
【题目】300℃时,将2molA和2molB两种气体混合于2L密闭容器中,发生如下发应:3A(g)+B(g) ![]() 2C(g)+2D(g);△H=Q.2min末达到平衡,生成0.8mol D.
2C(g)+2D(g);△H=Q.2min末达到平衡,生成0.8mol D.
(1)300℃时,该反应的平衡常数表达式为:K= . 已知K300℃<K350℃ , 则△H0(填“>”或“<”).
(2)在2min末时,B的平衡浓度为 , D的平均反应速率为 .
(3)若温度不变,缩小容器容积,则A的转化率(填“增大”、“减小”或“不变”),原因是 .
(4)如果在相同的条件下,上述反应从逆反应方向进行,开始时若加入C、D各 ![]() mol.若使平衡时各物质的物质的量浓度与原平衡相同,则还原该加入Bmol.
mol.若使平衡时各物质的物质的量浓度与原平衡相同,则还原该加入Bmol.
【答案】
(1) ;>
;>
(2)0.8mol/L;0.2mol/(L?min)
(3)不变;反应前后气体体积不变,压强对平衡无影响
(4)![]()
【解析】解:对于反应
3A(g)+ | B(g) | 2C(g)+ | 2D(g) | |
起始(mol) | 2 | 2 | 0 | 0 |
转化(mol) | 1.2 | 0.4 | 0.8 | 0.8 |
平衡(mol) | 0.8 | 1.6 | 0.8 | 0.8 |
;(1)化学平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则K= ![]() ,K300℃<K350℃,说明升高温度平衡向正反应方向移动,则正反应放热,△H>0,
,K300℃<K350℃,说明升高温度平衡向正反应方向移动,则正反应放热,△H>0,
所以答案是: ![]() ;>;(2)由上述计算可知,平衡时B的物质的量为1.6mol,所以B的平衡浓度为c(B)=
;>;(2)由上述计算可知,平衡时B的物质的量为1.6mol,所以B的平衡浓度为c(B)= ![]() =0.8mol/L,
=0.8mol/L,
平衡时D的物质的量为0.8mol,所以用D表示的平均反应速率为v(D)= ![]() =0.2mol/(Lmin),
=0.2mol/(Lmin),
所以答案是:0.8mol/L;0.2mol/(Lmin);(3)由方程式可知,气体的化学计量数之和前后相等,则反应前后气体体积不变,压强对平衡无影响,缩小容器容积,则A的转化率不变,
所以答案是:不变;反应前后气体体积不变,压强对平衡无影响;(4)为等效平衡,应前后气体体积不变,按化学计量数转化到左边,满足n(A):n(B)=1:1即可.
根据3A(g)+B(g) ![]() 2C(g)+2D(g)可知,C和D各
2C(g)+2D(g)可知,C和D各 ![]() mol,转化到左边可得A、2mol,B、
mol,转化到左边可得A、2mol,B、 ![]() mol.
mol.
令B的物质的量为nmol,则:2mol:(n+ ![]() )mol=2mol:2mol,解得n=
)mol=2mol:2mol,解得n= ![]() ,
,
所以答案是: ![]() .
.
【考点精析】关于本题考查的化学平衡的计算,需要了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能得出正确答案.

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案【题目】下列各组反应(表示物质均为反应物)中,反应刚开始时,放出氢气速率最大的是( )
编号 | 金属(块状) | 酸的浓度及体积 | 反应温度(℃) |
A | 0.2mol Mg | 10 mL2.5 mol·L-1硫酸 | 60 |
B | 0.2mol Mg | 40 mL3 mol·L-1盐酸 | 60 |
C | 0.2mol Fe | 50 mL5 mol·L-1盐酸 | 60 |
D | 0.2mol Mg | 20 mL2.5 mol·L-1硫酸 | 50 |
A. AB. BC. CD. D
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是( ) 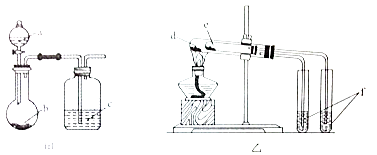
选项 | 实验试剂 | 实验结论 | ||
A | a.稀硫酸 | b.碳酸氢钠 | c.硅酸钠溶液 | 酸性:硫酸>碳酸>硅酸 |
B | a.稀盐酸 | b.二氧化锰 | c.溴化钠溶液 | 氧化性:MnO2>Cl2>Br2 |
C | d.小苏打 | e.苏打 | f.石灰水 | 热稳定性:苏打>小苏打 |
D | d.氯化钠 | e.氯化铵 | f.硝酸银溶液 | 沸点:氯化钠>氯化铵 |
A.A
B.B
C.C
D.D