题目内容
【题目】如图所示,将铁、铜通过导线相连,置于稀硫酸中. 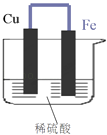
(1)铁片为极,其电极反应式 .
(2)铜片上的现象是 , 其发生的反应的类型是反应.(填“氧化”或“还原”)
(3)若导线中通过了0.6mol电子,Fe的质量理论上减少克.
【答案】
(1)负;Fe﹣2e﹣=Fe2+
(2)有大量气泡产生;还原
(3)16.8
【解析】解:(1)该原电池中,铁的活泼性大于铜,铁作负极,铁失电子变成离子进入溶液,所以铁片逐渐溶解,电极反应式为:Fe﹣2e﹣=Fe2+ , 所以答案是:负;Fe﹣2e﹣=Fe2+;(2)铜作正极,发生还原反应,铜电极上,氢离子得电子生成氢气2H++2e﹣=H2↑,所以看到的现象是:有大量气泡产生,所以答案是:有大量气泡产生;还原;(3)根据负极反应 Fe﹣2e﹣=Fe2+ , 当通过0.6mol电子,Fe的质量理论上减少0.3mol,质量减小16.8g,所以答案是:16.8.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
【题目】提纯下列物质(括号中为杂质),选择试剂和分离方法都正确的是( )
选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
A | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
B | 蔗糖(葡萄糖) | 水 | 过滤 |
C | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
D | 苯(碘) | 水 | 过滤 |
A. A B. B C. C D. D