题目内容
相对原子质量大于10的两种短周期元素X和Y能形成两种二元化合物A和B,已知A分子中X和Y的原子个数比为1∶2,A对氧气的相对密度为2,又知B分子中有一个X元素的原子,B在标准状况下的密度为3.57g/L,试判断:(1)X和Y各为何种元素;(2)A和B的化学式。
(1)X为硫,Y为氧。(2)A为SO2,B为SO3。
由题中数据可求得A的相对分子质量为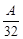 =2,A=64,B的相对分子质量为80(该气体在标准状况下的摩尔质量为3.57g·L-1×22.4L·mol-1=80g·mol-1),设A的化学式为(XY2)m,B的化学式为XYn。
=2,A=64,B的相对分子质量为80(该气体在标准状况下的摩尔质量为3.57g·L-1×22.4L·mol-1=80g·mol-1),设A的化学式为(XY2)m,B的化学式为XYn。
若m=1时,则有x+2y=64 ①
x+ny=80 ②
②-①得(n-2)·y=16,由于n必为自然数,当n分别为1、2、3、4时,求得y的值分别为-16,0、16、8,根据题意y>10,故合理的解释为n=3,y=16。y=16代入①式得x=32。
所以x为硫元素,y为氧元素;A为SO2,B为SO3,
若m=2时,则有2x+4y="64" ③
x+ny=80
经上述方法讨论,无合理的解。
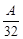 =2,A=64,B的相对分子质量为80(该气体在标准状况下的摩尔质量为3.57g·L-1×22.4L·mol-1=80g·mol-1),设A的化学式为(XY2)m,B的化学式为XYn。
=2,A=64,B的相对分子质量为80(该气体在标准状况下的摩尔质量为3.57g·L-1×22.4L·mol-1=80g·mol-1),设A的化学式为(XY2)m,B的化学式为XYn。若m=1时,则有x+2y=64 ①
x+ny=80 ②
②-①得(n-2)·y=16,由于n必为自然数,当n分别为1、2、3、4时,求得y的值分别为-16,0、16、8,根据题意y>10,故合理的解释为n=3,y=16。y=16代入①式得x=32。
所以x为硫元素,y为氧元素;A为SO2,B为SO3,
若m=2时,则有2x+4y="64" ③
x+ny=80
经上述方法讨论,无合理的解。

练习册系列答案
相关题目
 互为等电子体(原子数相同、电子数相同)。请在表中空格里填入四种相关物质的化学式。
互为等电子体(原子数相同、电子数相同)。请在表中空格里填入四种相关物质的化学式。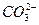
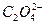
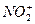
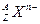 核外有18个电子,则它的质子数为_________,核内中子数为_________。
核外有18个电子,则它的质子数为_________,核内中子数为_________。