题目内容
13.根据所给仪器,回答下列回问题: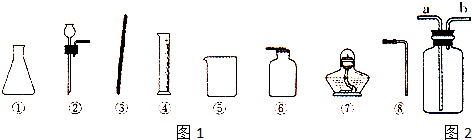
(1)配置100g 5%的氯化钠溶液,需要胶头滴管、药匙、托盘天平和上述仪器中的(填序号)③④⑤,量取液体时,由于读数时仰视造成所配溶液的溶质质量分数偏小填“偏大”、“偏小”或“不变”).
(2)在实验室,某同学要利用所给仪器制取一瓶氧气,应选用的仪器有(填序号)①②⑥⑧,反应的化学方程式为2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.若用如图所示的装置来收集该气体,气体应从a(填“a”或“b”)通入.
分析 (1)根据配制溶质质量分数一定的溶液的基本步骤、根据各操作所需要使用的仪器;
根据量取水时量偏大(量水时仰视读数)解答;
(2)依据制备氧气的反应物的状态与反应条件选择合适的装置;氧气密度大于空气密度,应选择向上排气法收集.
解答 解:(1)配制一定质量分数的食盐溶液,操作方法为:1、计算所需氯化钠和水的质量.2、用托盘天平称量所需氯化钠的质量,倒入烧杯中.3、用量筒量取所需的水,倒入盛有氯化钠的烧杯中,用玻璃棒搅拌使其溶解,用到的仪器有:胶头滴管、药匙、托盘天平、烧杯、玻璃棒、量筒,所以还需要的仪器是:烧杯、玻璃棒、量筒;
用量筒量取水时仰视读数,读数偏小,量取到的水偏大,溶质不变,溶剂多了,溶质质量分数偏小;
故答案为:③④⑤;偏小;
(2)实验室制取氧气用二氧化锰做催化剂,分解双氧水的方法,方程式:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑;
反应物为固体与液体,条件不加热,可以用①②⑥⑧仪器制备;
氧气密度大于空气密度,应选择向上排气法收集,应选择a口进入,b口出;
故答案为:①②⑥⑧;2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑;a.
点评 本题考查了配制溶质质量分数一定的溶液、实验室制备氧气的原理和装置的选择,熟悉配制原理和制备氧气反应的原理是解题关键,题目难度不大.

练习册系列答案
相关题目
4.下列指定反应的离子方程式正确的是( )
| A. | 氯气溶于水:Cl2+H2O?2H++Cl-+ClO- | |
| B. | Na2CO3溶液中加入少量稀盐酸:CO32-+2H+═CO2↑+H2O | |
| C. | 酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+═I2+3H2O | |
| D. | NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O |
18.在化学学习中使用数轴的表示方法可起到直观、形象的效果,下列表达中不正确的是( )
| A. | 常温下溶液的pH与酸碱性的关系: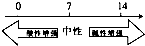 | |
| B. | 硫的化合物中化合价与其氧化性、还原性的关系: | |
| C. | Fe在Cl2中的燃烧产物: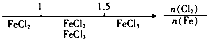 | |
| D. | 氨水与SO2反应后溶液中的铵盐: |
2.H2O2(l)在有MnO2条件下和无MnO2条件下分解的能量变化如图所示,下列说法正确的是( )

| A. | 有MnO2条件下的反应曲线是a曲线 | |
| B. | a曲线变为b曲线,反应的活化分子百分数增大 | |
| C. | a曲线变为b曲线,平衡时H2O2的转化率增大 | |
| D. | b曲线的热化学方程式为:H2O2(l)═H2O(l)+$\frac{1}{2}$O2(g)△H=-(E1-E2)KJ•mol-1 |
3.2mol Cl2和2mol CO2相比较,下列叙述中正确的是( )
| A. | 分子数相等 | B. | 原子数相等 | C. | 质子数相等 | D. | 质量相等 |
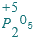 .
. .在工业上,用氯化钠为原料,在碱性溶液中,通过电解的方法可制得NaClO,用离子方程式表示制取NaClO的电解总反应:Cl-+H2O$\frac{\underline{\;通电\;}}{\;}$ClO-+H2↑,将等浓度等体积的NaClO与Na2SO3溶液混合后,两者恰好完全反应,写出混合过程的离子反应方程式ClO-+SO32-=Cl-+SO42-.
.在工业上,用氯化钠为原料,在碱性溶液中,通过电解的方法可制得NaClO,用离子方程式表示制取NaClO的电解总反应:Cl-+H2O$\frac{\underline{\;通电\;}}{\;}$ClO-+H2↑,将等浓度等体积的NaClO与Na2SO3溶液混合后,两者恰好完全反应,写出混合过程的离子反应方程式ClO-+SO32-=Cl-+SO42-.