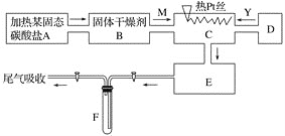
��Ŀ����
����Ŀ��ȼú�����CO2��CO��SO2�ȴ�����Ⱦ�ȼú�������ط�Ӧ���Ȼ�ѧ����ʽ���£�
CaSO4(s)+CO(g) ![]() CaO(s) + SO2(g) + CO2(g) ��H1 =+281.4kJ/mol (��Ӧ��)
CaO(s) + SO2(g) + CO2(g) ��H1 =+281.4kJ/mol (��Ӧ��)
1/4CaSO4(s)+CO(g) ![]() 1/4CaS(s) + CO2(g) ��H2 = -43.6kJ/mol (��Ӧ��)
1/4CaS(s) + CO2(g) ��H2 = -43.6kJ/mol (��Ӧ��)
��1�����㷴ӦCaO(s) + 3CO(g ) + SO2(g) ![]() CaS(s) +3 CO2(g) ��H=____________��
CaS(s) +3 CO2(g) ��H=____________��
��2��һ���¶��£���ij�����ܱ������м���CaSO4(s)��1molCO����ֻ������ӦI��������˵���÷�Ӧ�Ѵﵽƽ��״̬����_____________������ţ�
a�������ڵ�ѹǿ�������仯 b������(CO)������(CO2)
c��������������ܶȲ������仯 d��n��CO��+n��CO2��=1mol
��3��һ���¶��£����Ϊ1L�����м���CaSO4(s)��1molCO����ֻ������ӦII�����CO2�����ʵ�����ʱ��仯����ͼ������A��ʾ��
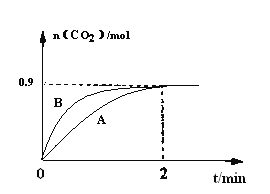
����0~2min�ڵ�ƽ����Ӧ����v��CO��=____________��
������B��ʾ����������A��ȸı�ķ�Ӧ��������Ϊ____________���һ�����ɣ���
����Ҫ��߷�Ӧ��ϵ��CO2������������ɲ�ȡ�Ĵ�ʩΪ__________________��
��4��һ���¶��£�������ܱ������м���CaSO4(s)��1molCO��������˵����ӦI�ͷ�ӦIIͬʱ��������________________������ţ���
a.��Ӧ��������ʹƷ����ɫ
b.��Ӧ�����У�CO�����������С
c.��Ӧ��ϵ��ƽ��ǰ��SO2��CO2���������Ũ��֮����ʱ�䷢���仯
d.��ϵѹǿ������
��5���̵����е�SO2��CO2�������������Ҳ��������������Һ���ա�
��֪��25��ʱ��̼���������ĵ���ƽ�ⳣ���ֱ�Ϊ��
̼�� K1��4.3��10-7 K2��5.6��10��11
������K1��1.5��10��2 K2��1.0��10��7
��������ʵ�У����ܱȽ�̼���������������ǿ������__________�����ţ���
a.25���£�����̼����ҺpH���ڱ�����������ҺpH
b��25���£���Ũ�ȵ�NaHCO3��ҺpH����NaHSO3��Һ
c����SO2����ͨ��NaHCO3��Һ���ݳ�����ͨ�����ʯ��ˮ������ʯ��ˮ�����
d����CO2����ͨ��NaHSO3��Һ���ݳ�����ͨ��Ʒ����Һ��Ʒ����Һ����ɫ
��25��ʱ������������Һ�����̵������õ�pH=6������Һ������Һ��c��SO32-����c��HSO3-��=___________��
��H 2SO3��Һ��NaHCO3��Һ��Ӧ����Ҫ���ӷ���ʽΪ____________________________��
���𰸡� -455.8kJ/mol ac 0.45mol/(Lmin) ���������������ѹǿ�� �����¶� c ac 1��10 H 2SO3+HCO3-=H SO3-+CO2��+H2O
����������1�����ݸ�˹���ɣ���Ӧ����4-��Ӧ�������ɵã�CaO(s) + 3CO(g ) + SO2(g) ![]() CaS(s) +3 CO2(g) ��H=-455.8kJ/mol����ȷ�𰸣�-455.8kJ/mol��
CaS(s) +3 CO2(g) ��H=-455.8kJ/mol����ȷ�𰸣�-455.8kJ/mol��
��2����Ӧ��CaSO4(s)+CO(g) ![]() CaO(s) + SO2(g) + CO2(g) ��H1 =+281.4kJ/mol���÷�ӦΪ��Ӧǰ������б仯�ķ�Ӧ����˵������ڵ�ѹǿ�������仯ʱ�������ж���Ӧ�Ѵﵽƽ��״̬��a��ȷ����Ӧ����֮�Ⱥͻ�ѧ����ϵ�������ȣ��������ʵķ�Ӧ���ʷ���ͬ����˵����Ӧ�Ѵﵽƽ��״̬��b����Ӧ��������������ӣ�������������䣬���������������ܶȲ������仯������˵����Ӧ�Ѵﵽƽ��״̬��c ��ȷ�� n��CO��+n��CO2��=1mol������ʾ̼ԭ�ӵ������غ㣬�����ж���Ӧ�Ѵﵽƽ��״̬��d������ȷѡ��ac��
CaO(s) + SO2(g) + CO2(g) ��H1 =+281.4kJ/mol���÷�ӦΪ��Ӧǰ������б仯�ķ�Ӧ����˵������ڵ�ѹǿ�������仯ʱ�������ж���Ӧ�Ѵﵽƽ��״̬��a��ȷ����Ӧ����֮�Ⱥͻ�ѧ����ϵ�������ȣ��������ʵķ�Ӧ���ʷ���ͬ����˵����Ӧ�Ѵﵽƽ��״̬��b����Ӧ��������������ӣ�������������䣬���������������ܶȲ������仯������˵����Ӧ�Ѵﵽƽ��״̬��c ��ȷ�� n��CO��+n��CO2��=1mol������ʾ̼ԭ�ӵ������غ㣬�����ж���Ӧ�Ѵﵽƽ��״̬��d������ȷѡ��ac��
��3����1/4CaSO4(s)+CO(g) ![]() 1/4CaS(s) + CO2(g) ��H2 = -43.6kJ/mol (��Ӧ��)������ͼ���֪����Ӧ���е�2minʱ������n��CO2��=0.9mol�����ݷ���ʽ�����ʼ�ķ�Ӧ��ϵ��֪������n��CO��=0.9mol����0~2min�ڵ�ƽ����Ӧ����v��CO��=0.9/1��2=0.45mol/(Lmin)����ȷ�𰸣�0.45mol/(Lmin)��
1/4CaS(s) + CO2(g) ��H2 = -43.6kJ/mol (��Ӧ��)������ͼ���֪����Ӧ���е�2minʱ������n��CO2��=0.9mol�����ݷ���ʽ�����ʼ�ķ�Ӧ��ϵ��֪������n��CO��=0.9mol����0~2min�ڵ�ƽ����Ӧ����v��CO��=0.9/1��2=0.45mol/(Lmin)����ȷ�𰸣�0.45mol/(Lmin)��
��ͨ�����߱仯��֪������B����ʱ�����̣����ʼӿ죬����ƽ�ⲻ�����ƶ������÷�ӦΪ��Ӧǰ���������ķ�Ӧ����˿���ͨ���������������ѹǿ�ķ�������ʵ�������仯����ȷ�𰸣����������������ѹǿ����
�۸÷�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�����ƣ� CO2�����������������ѹǿ��ƽ�ⲻһ����CO2������������䣻��ȷ�𰸣������¶ȡ�
��4��CaSO4(s)+CO(g) ![]() CaO(s) + SO2(g) + CO2(g) ��H1 =+281.4kJ/mol (��Ӧ��) ��1/4CaSO4(s)+CO(g)
CaO(s) + SO2(g) + CO2(g) ��H1 =+281.4kJ/mol (��Ӧ��) ��1/4CaSO4(s)+CO(g) ![]() 1/4CaS(s) + CO2(g) ��H2 = -43.6kJ/mol (��Ӧ��)��SO2�ܹ�ʹƷ����ɫ����Ӧ��������ʹƷ����ɫ��ֻ��˵����Ӧ������a����������Ӧ���̾�����CO����Ӧ�����У�CO�����������С�����ж���ӦI�ͷ�ӦII�Ƿ�ͬʱ������b����Ӧ���в���SO2��CO2Ϊ1:1����������ӦIIʱ������CO2�������ɣ���˷�Ӧ��ϵ��ƽ��ǰ��SO2��CO2���������Ũ��֮����ʱ�䷢���仯������˵����ӦI�ͷ�ӦIIͬʱ������c��ȷ����ӦIΪ����������ӷ�Ӧ����ϵѹǿ��������ӦII��������������仯����ϵѹǿ���䣬��˲���˵����ӦI�ͷ�ӦIIͬʱ������d������ȷѡ��c��
1/4CaS(s) + CO2(g) ��H2 = -43.6kJ/mol (��Ӧ��)��SO2�ܹ�ʹƷ����ɫ����Ӧ��������ʹƷ����ɫ��ֻ��˵����Ӧ������a����������Ӧ���̾�����CO����Ӧ�����У�CO�����������С�����ж���ӦI�ͷ�ӦII�Ƿ�ͬʱ������b����Ӧ���в���SO2��CO2Ϊ1:1����������ӦIIʱ������CO2�������ɣ���˷�Ӧ��ϵ��ƽ��ǰ��SO2��CO2���������Ũ��֮����ʱ�䷢���仯������˵����ӦI�ͷ�ӦIIͬʱ������c��ȷ����ӦIΪ����������ӷ�Ӧ����ϵѹǿ��������ӦII��������������仯����ϵѹǿ���䣬��˲���˵����ӦI�ͷ�ӦIIͬʱ������d������ȷѡ��c��
��5���ٶ�������Ͷ�����̼���ܽ�Ȳ�ͬ,�����䱥����ҺŨ�Ȳ�ͬ,��ʹ�����̶����,����Һ��pHҲ����,���Բ��ܾݴ��ж�����ǿ��,A��ȷ��ͬ����,��Ũ�ȵ����������ƺ�̼��������Һ,̼��������Һ�ļ���ǿ,˵��̼���������ˮ��̶ȴ����������������,������������Դ���̼��, b��������������Ͷ�����̼����ʹ����ʯ��ˮ�����,����Ķ����������,���Բ���ȷ����������ʹ����ʯ��ˮ�����,����֤���������ǿ��, c��ȷ��Ʒ����Һ����ɫ��˵��û�ж����������������̼����Ʊ������ᣬ�Ӷ�˵�����������Դ���̼�����ԣ�d������ȷѡ��ac��
������������Һ�����̵�������������������������Һ��ˮ��ƽ�ⳣ��Ϊ��HSO3-����c(H+)/c��SO32-��=KW/K2,,��֪pH=6������Һ��c(H+)=10-6mol/L��c��SO32-��/c��HSO3-��= c(H+)��K2/ KW=10-6��1.0��10��7/10-14=10-1=1:10����ȷ�𰸣�1:10��
�۸��ݵ���ƽ�ⳣ����֪���ԣ�H 2SO3>H 2CO3> H SO3-> HCO3-������H 2SO3��Һ��NaHCO3��Һ��Ӧ�������������ƺͶ�����̼���壬���ӷ���ʽΪH 2SO3+HCO3-=H SO3-+CO2��+H2O����ȷ�𰸣�H 2SO3+HCO3-=H SO3-+CO2��+H2O��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ�������Ѱ۳����ᣨ��Ҫ�����ᡢFe3+��Fe2+��TiO2+��Al3+���Ʊ����������[��NH4��2S2O8]��ͬʱ����TiO��OH��2�ļ�Ҫ�������£�
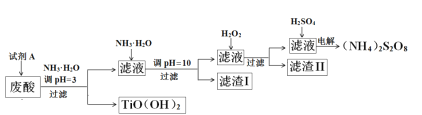
��֪��i.����������ȫ�����������������pH
�������� | TiO2+ | Fe3+ | Fe2+ | Al3+ |
��ʼ������PH | 1.2 | 1.9 | 7.0 | 3.2 |
������ȫ��pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii.pH>7ʱ��Fe2+��������Fe��II����������[Fe��NH3��2]2+��
��ش��������⣺
��1��Ϊ��֤����TiO(OH)2�Ĵ��ȣ������Լ�AҪ�������Լ�AΪ___________��
��2�����ջ��յ�TiO��OH��2����õ�TiO2�ᷢ�ƣ����Ƶ����ʿ�����_______���ѧʽ����
��3������I����Ҫ�ɷֳ�Fe(OH)2��Al��OH��3�⣬������______________��
��4������H2O2��Ŀ������������Fe��II����������[Fe��NH3��2]2+����ƽ�������ӷ���ʽ��2[Fe��NH3��2]2+ +________+4H2O +H2O2 =_______ + 4NH3��H2O
��5������Ʊ���������淋�װ������ͼ��ʾ��
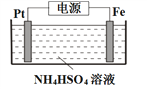
��S2O82-��SԪ�صĻ��ϼ�Ϊ+6�����й���������ĿΪ___________��
�ڵ��ʱ�����缫���ӵ�Դ��___________����
�۳����£����Һ�к�������Ҫ������ʽ�� pH �Ĺ�ϵ����ͼ��ʾ��
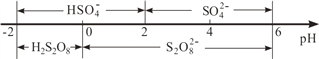
�������ŵ��������ҪΪHSO4-���������������Һ�� pH ��ΧΪ______�������ĵ缫��ӦʽΪ______________________��