题目内容
如图所示是用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL未知浓度盐酸(酚酞作指示剂)的滴定曲线。下列说法正确的是
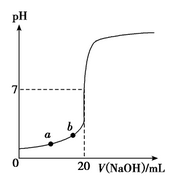

| A.水电离出的氢离子浓度:a>b |
| B.盐酸的物质的量浓度为:0.010 0 mol·L-1 |
| C.指示剂变色时,说明盐酸与NaOH恰好完全反应 |
| D.当滴加NaOH溶液10.00 mL时(忽略反应前后体积变化),该混合液的pH=1+lg 3 |
D
试题分析:A、a点pH小,H+浓度大,对H2O的电离平衡抑制作用更强,所以水电离出的氢离子浓度:a<b,错误;B、滴定20.00 mL该盐酸至pH等于7时,消耗0.100 0 mol·L-1 NaOH溶液20.00 mL,则HCl浓度等于NaOH浓度,也为0.100 0 mol·L-1,错误;C、因为所用指示剂为酚酞,酚酞的变色范围为pH8~10,指示剂变色时,说明盐酸与NaOH不是恰好完全反应,错误;D、滴加NaOH溶液10.00 mL时, pH=—lgc(H+)=—lg[(0.100 0 mol·L-1×0.02L—0.100 0 mol·L-1×0.01L)÷0.03L ]= 1+lg 3,正确。

练习册系列答案
相关题目
 H++OH-
H++OH-  H>0,下列叙述正确的是( )
H>0,下列叙述正确的是( )
 相等
相等