题目内容
【题目】砷,稼和钢均为重要的合金材料,在工业生产和科研领域均有重要应用。
请回答下列问题:
(1)基态Ga原子中有_______种能量不同的电子,其未成对电子数目为_______。
(2)GaAs的晶胞与金刚石相似,其中As原子位于晶胞的顶点和面心,则Ga原子的配位数为_______。Ga、Ge、As、Se四种基态原子的第一电离能由大到小的顺序为_________。
(3)Cu3(AsO4)2是一种木材防腐剂,其阴离子中As原子的杂化轨道类型为______,H3AsO4的酸性强于H3AsO3的原因为_________________。
(4)[Cu(NH3)4]SO4是一种重要的配合物,与SO42-互为等电子体的分子的化学式为______ (任写一种),一定压强下,将NH3和PH3的混合气体降温,首先液化的为_______。
(5)晶胞有两个基本要素:
①原子坐标参数:表示晶胞内部各原子的相对位置,一种钇钡铜氧晶体的晶胞结构如图所示,其中原子坐标参数A 为(0,0 ,0 ),B为(0,1,1),C为(1,1,0 );则D原子的坐标参数为___________。
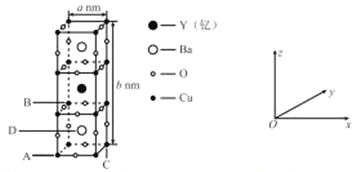
②晶胞参数,描述晶胞的大小和形状。己知:该钇钡铜氧晶体的晶饱参数分别为anm、bnm,阿伏加德罗常数的值为NA,其密度为_______g·cm -3(列出计算式即可)。
【答案】 8 1 4 As>Se>Ge>Ga sp3 H3AsO4的非羟基氧原子多,As的正电性更高,羟基中的O原子的电子向As偏移程度大,更容易电离出H+ CCl4(或SiCl4或CBr4或SiF4) NH3 (1/2,1/2,1/2) ![]()
【解析】(1)基态Ga原子的电子排布式为1s22s22p63s23p63d104s24p1有8种轨道,所以有8种能量不同的电子,其未成对电子在4p轨道,数目为1。
(2)GaAs的晶胞与金刚石相似,两者为等电子体,金刚石中C原子的配位数为4,所以Ga原子的配位数为4。第VA(np3半充满)元素的价电子排布比较特殊,所以第一电离能也是比较特殊的,它们高于邻近的元素,所以Ga、Ge、As、Se四种基态原子的第一电离能由大到小的顺序为As>Se>Ge>Ga。
(3)Cu3(AsO4)2是一种木材防腐剂,其阴离子中As原子的杂化轨道类型为sp3,H3AsO4的酸性强于H3AsO3的原因为H3AsO4的非羟基氧原子多,As的正电性更高,羟基中的O原子的电子向As偏移程度大,更容易电离出H+。
(4)[Cu(NH3)4]SO4是一种重要的配合物,与SO42-互为等电子体的分子的化学式为CCl4(或SiCl4或CBr4或SiF4),一定压强下,将NH3和PH3的混合气体降温,因为氨分子间可以形成氢键,所以首先液化的是NH3。
(5)①由原子坐标参数A 为(0,0 ,0 ) 、B为(0,1,1)、C为(1,1,0 )可知,该晶胞底部为一正方体,所以D原子的坐标参数为(1/2,1/2,1/2)。
②由图可知,该晶胞中有1个Y原子、2个Ba原子、12![]() +8
+8![]() =7个O原子、8
=7个O原子、8![]() +8
+8![]() =3个Cu原子,所以该晶体的化学式为YBa2Cu3O7、摩尔质量为667g/mol,则1mol该晶胞的质量为667g、体积为
=3个Cu原子,所以该晶体的化学式为YBa2Cu3O7、摩尔质量为667g/mol,则1mol该晶胞的质量为667g、体积为
NA![]() cm3=a2bNA
cm3=a2bNA![]() cm3,所以该钇钡铜氧晶体密度为
cm3,所以该钇钡铜氧晶体密度为
![]() 。
。

