题目内容
【题目】下列各组中的离子,能在溶液中大量共存的是
A.Fe3+、Na+、Cl-、SCN- B.Fe3+、SO42-、Mg2+、Na+
C.AlO2-、Na+、Cl-、H+ D.NH4+、K+、CO32-、OH-
【答案】B
【解析】
试题分析:A.Fe3+与SCN- 发生络合反应生成Fe(SCN)3,所以不能大量共存,故A错误;B.Fe3+、SO42-、Mg2+、Na+在溶液中相互不发生化学反应,可以大量共存,故B正确;C.AlO2-与H+在水溶液中发生反应生成氢氧化铝沉淀,所以不能大量共存,故C错误;D.NH4+与OH-在水溶液中发生反应生成弱电解质一水合氨,所以不能大量共存,故D错误。故选B。

 53随堂测系列答案
53随堂测系列答案【题目】短周期主族元素A、B、C、D、E原子序数依次增大 ,A是元素周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C原子的最外层电子数是次外层电子数的3倍,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物W分子含有相同的电子数。
(1)A、C、D形成的化合物中含有的化学键类型为_______。W的电子式_________。
(2)在某温度下容积均为2 L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g)![]() X(g) H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
X(g) H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
实验 | 甲 | 乙 | 丙 |
初始投料 | 2 mol A2、1 mol BC | 1 mol X | 4 mol A2、2 mol BC |
平衡时n(X) | 0.5 mol | n2 | n3 |
反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
体系的压强 | P1 | P2 | P3 |
反应物的转化率 |
|
|
|
① 计算该温度下此反应的平衡常数K =_________________。
②三个容器中的反应分别达平衡时下列各组数据关系正确的是___________(填字母)。
A.α1+α2=1 B.Q1+Q2=Q C.α3<α1
D.P3<2P1=2P2 E.n2<n3<1.0 mol F.Q3=2Q1
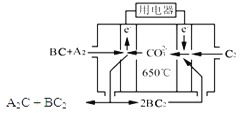
(3)熔融碳酸盐燃料电池(MCFC)是一种高温燃料电池,被称为第二代燃料电池,是未来民用发电的理想选择方案之一,其工作原理如图所示。现以A2(g)、BC(g)为燃料,以一定比例Li2CO3和Na2CO3低熔混合物为电解质。写出该碳酸盐燃料电池(MCFC)正极的电极反应式____________________________。