题目内容
用4种溶液进行实验,下表中“试剂和操作”与“现象”对应关系正确的是
| 选项 | 试剂和操作 | 现象 |
| A | 向AlCl3溶液中滴入过量的氨水 | 溶液先有白色沉淀,后来沉淀消失 |
| B | 向新生成的AgC1浊液中滴入KI溶液,振荡 | 白色沉淀逐渐转化为黄色沉淀 |
| C | 向Ca(C1O)2溶液中先通入CO2,再加入少量品红溶液 | 溶液先变浑浊,通入CO2后品红的红色不褪去 |
| D | 向BaC12溶液中先通入SO2,再通入过量NO2 | 先生成沉淀,后来沉淀消失 |
B
解析试题分析:由于氢氧化铝是两性氢氧化物,氨水的碱性比氢氧化铝强,则AlCl3+3NH3?H2O=Al(OH)3↓+3NH4Cl,由于一水合氨是弱碱,氢氧化铝不能溶于过量的氨水,因此先产生白色沉淀,后沉淀不溶解,故A选项错误;由于溶解度(S)或溶度积(Ksp):AgCl>AgI,AgCl浊液中存在如下沉淀溶解平衡:AgCl(s)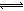 Ag++Cl—,滴入KI溶液时,I—与Ag+结合生成更难溶、黄色的AgI沉淀,减小银离子浓度,促进AgCl溶解平衡向正反应方向移动,白色沉淀变为黄色沉淀,故B选项正确;由于碳酸的酸性比次氯酸强,则Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,由于次氯酸具有强氧化性,能使品红溶液褪色,故C选项错误;盐酸的酸性比亚硫酸强,BaCl2溶液中重通入SO2时无明显现象,由于NO2具有强氧化性,能将SO2氧化为硫酸根离子,因此再通入NO2时,产生白色的硫酸钡沉淀,故D选项错误。
Ag++Cl—,滴入KI溶液时,I—与Ag+结合生成更难溶、黄色的AgI沉淀,减小银离子浓度,促进AgCl溶解平衡向正反应方向移动,白色沉淀变为黄色沉淀,故B选项正确;由于碳酸的酸性比次氯酸强,则Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,由于次氯酸具有强氧化性,能使品红溶液褪色,故C选项错误;盐酸的酸性比亚硫酸强,BaCl2溶液中重通入SO2时无明显现象,由于NO2具有强氧化性,能将SO2氧化为硫酸根离子,因此再通入NO2时,产生白色的硫酸钡沉淀,故D选项错误。
考点:考查常见无机物的主要性质,涉及氢氧化铝的两性、氯化银沉淀溶解平衡的移动、沉淀的转化、次氯酸的弱酸性和强氧化性、二氧化氮的强氧化性、二氧化硫的还原性、亚硫酸与盐酸的酸性等。

 阅读快车系列答案
阅读快车系列答案对下列实验现象的解释不正确的是
| 选项 | 实验现象 | 解释 |
| A | 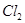 使鲜艳的红色花瓣褪色 使鲜艳的红色花瓣褪色 | 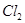 具有漂白性 具有漂白性 |
| B | 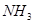 与 与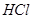 气体接触时有白烟产生 气体接触时有白烟产生 | 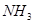 与 与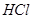 反应生成固体小颗粒 反应生成固体小颗粒 |
| C | 常温下可用铁制容器运输浓硫酸 | 铁在常温下与浓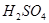 发生钝化 发生钝化 |
| D | 蔗糖遇浓硫酸变黑 | 浓硫酸具有脱水性 |
下列叙述不正确的是
| A | B | C | D |
 |  |   |  |
| 闪电时会发生反应: N2+O2  2NO 2NO | 利用丁达尔效应证明烧杯中的分散系是胶体 | 蔗糖中加入浓硫酸搅拌后变黑,因为浓硫酸有吸水性 | 加热时熔化的铝不滴落,证明Al2O3的熔点比Al高 |
下列说法中,不正确的是
①建国60周年庆典晚会上,天安门广场燃放的焰火是某些金属元素魅力的展现
②酒精灯加热铝箔至熔化,铝并不滴落,说明铝表面有一层致密的氧化膜
③为测定熔融氢氧化钠的导电性,将氢氧化钠固体放在石英坩埚中加热熔化
④电解从海水中得到的氯化镁溶液可获得金属镁
⑤KI淀粉溶液中通入Cl2,溶液变蓝,说明Cl2能与淀粉发生显色反应
| A.③④⑤ | B.①③④ | C.①③④⑤ | D.①②③④ |
化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应中属于这种情况的是
①过量的锌与18mol/L的硫酸反应; ②过量的氢气与少量氮气在催化剂存在下充分反应;
③浓盐酸与过量的MnO2; ④过量铜与浓硫酸;
⑤过量稀硝酸与银反应; ⑥过量稀硫酸与块状石灰石
| A.②③④⑥ | B.②③⑤ | C.①④⑤ | D.①②③④⑤⑥ |
对下列过程中发生反应的叙述正确的是
| A.海水中含有钾元素,只需经过物理变化可以得到钾单质 |
| B.Na+、Mg2+、Al3+得电子能力很弱,故常用电解熔融氯化物的方法来制备其单质 |
| C.从铝土矿中分离出氧化铝的过程中不涉及氧化还原反应 |
| D.从海水中提取溴单质的过程中所涉及的反应均是置换反应 |
下列叙述正确的是
| A.将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀, |
| B.在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解 |
| C.纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量CuSO4固体;速率不改变. |
| D.向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4溶液,沉淀消失 |
下列事实与结论(或推论)均正确的是
| A.将氨水加到盛有AgCl固体的试管中,AgCl固体完全溶解,说明所得溶液中c(Ag+)c(Cl-)>Ksp(AgCl) |
| B.物质的量之比为1: 2的Na2O2和NaHCO3的固体混合物,在密闭容器中充分加热反应后,残留的固体是Na2CO3 |
| C.向FeBr2溶液中通入少量的氯气,再向反应后的溶液中滴加KSCN溶液,结果溶液变为红色;那么向FeI2溶液中通入少量的氯气,也会出现同样的现象 |
| D.将某混合气体通入品红溶液中,溶液不褪色,该气体中无Cl2 |